Kémia Tanuló
A KNO2 kémiai képletű kálium-nitrit sárgásfehér kristályos és folyékony por, amely vízben, alkoholban és folyékony ammóniában oldódik. Káliumsó és ionos vegyület . A KNO2 erős oxidálószer és nem kompatibilis erős savakkal, erős redukálószerekkel, cianidokkal, ammóniumsókkal és éghető anyagokkal .

Kálium-nitrit
Kálium-nitrit azonosítása |
|
| CAS szám | 7758-09- |
| .0 | |
| PubChem CID | 516910 |
| ChemSpider ID | 22857 |
| EC Number | 231-832-4 |
Hogyan állítható elő
A kálium-nitrit kálium-nitrát ólommal való hevítésével állítható elő.
KNO3 + Pb = KNO2 + PbO
Ha akarod, ólom helyett cinket vagy rezet is használhatsz .

Kálium-nitrit képlete
A kálium-nitrit tulajdonságai és jellemzői
Általános tulajdonságok |
|
| Moláris tömeg/molekulatömeg | 85.103 g/mol |
Fizikai tulajdonságok |
|
| Szín/megjelenés | Fehér vagy enyhén sárga kristályok |
| olvadáspont/fagyáspont | 441°C, 825.8°F |
| Fűtőpont | 537°C, 998.6°F |
| Sűrűség | 1.9 g cm-3 |
| Anyagállapot szobahőmérsékleten (normál fázis) | Szilárd |
| Hőterhelhetőség | 107.4 J/mol K |
| Specifikus fajsúly | 1.915 |
Kémiai tulajdonságok |
|
| Gyúlékonyság | Igen. |
| Vízben oldhatóság | 3120 g/l (25oC-on) |
| pH | 8.40 (bázikus) |
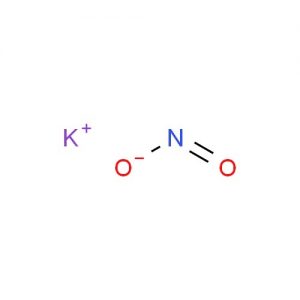
Kálium-nitrit szerkezete
Kiemelt reakciók
A kálium-nitrit és tömény salétromsav közötti reakció során kálium-nitrát, nitrogén-dioxid, nitrogén-oxid és víz keletkezik .
2KNO2 + 2HNO3 = 2KNO3 + NO2 + NO + NO + H2O
A KNO2 telített oldata koncentrált kénsavval reagálva kálium-szulfátot, nitrogén-dioxidot, salétrogén-oxidot és vizet eredményez .
2KNO2 + H2SO4 = K2SO4 + NO2 + NO + NO + H2O
A kálium-nitrit tömény sósavval reagálva kálium-nitrátot, kálium-kloridot, salétrogén-oxidot és vizet képez .
3KNO2 + 2HCl = KNO3 + 2KCl + 2NO + H2O
Kálium-nitrit felhasználása
- Más vegyi anyagok, hőátadó sók előállítására .
- Kémiai analízisben .
- Élelmiszer-adalékanyagként (tartósítószer), műtrágyákban .
- Cianidmérgezés ellenszereként .
- Agytágítószerként az orvostudományban .
- Marásgátlóként és korróziógátlóként .
Veszélyes
Veszélyes, ha lenyelik. Felhevítés esetén robbanásveszélyt okozhat. A vegyület 350°C-on kezd bomlani és mérgező kálium-oxid gőzöket bocsát ki. A KNO2 az élelmiszerekben növelheti a rák kockázatát .
Kálium-nitrit ára
10 gramm vegyület ára 19,2 dollár körül van .
- Kálium-nitrit – Pubchem.ncbi.nlm.nih.gov
- Kálium-nitrit – Chemspider.com
- Melyik a kálium-nitrit 0,25M-os oldatának pH-ja? – Quora.com
- Kálium-nitrit – Chemicalbook.com
- Kálium-nitrit előállítása – Prepchem.com
- Kálium-nitrit – Chemicalbook.com
- Kálium-nitrit reagál salétromsavval – Chemiday.com
- Kálium-nitrit reagál kénsavval – Chemiday.com
- Kálium-nitrit reagál hidrogén-kloriddal – Chemiday.com