Chemistry Learner
Nitritul de potasiu reprezentat prin formula chimică KNO2 este o pulbere cristalină albă gălbuie și delicvescentă care este solubilă în apă, alcool și amoniac lichid . Este o sare de potasiu și un compus ionic . KNO2 este un oxidant puternic și este incompatibil cu acizii puternici, cu agenții reducători puternici, cu cianurile, cu sărurile de amoniu și cu materialele combustibile .

Nitrit de potasiu
Nitrit de potasiu Identificare |
|
| Număr CAS | 7758-09-0 |
| PubChem CID | 516910 |
| ChemSpider ID | 22857 |
| Număr CE | 231-832-4 |
Cum se obține
Nitritul de potasiu poate fi preparat prin încălzirea nitratului de potasiu cu plumb.
KNO3 + Pb = KNO2 + PbO
Dacă doriți, puteți folosi zinc sau cupru în loc de plumb .

Formula nitritului de potasiu
Proprietăți și caracteristici ale nitritului de potasiu
Proprietăți generale |
|
| Masă molară/greutate moleculară | |
Proprietăți fizice |
|
| Culoare/aspect | |
| Punct de topire/punct de congelare | |
| Punctul de fierbere | 537°C, 998,6°F |
| Densitate | 1.9 g cm-3 |
| Stare a materiei la temperatura camerei (fază normală) | Solid |
| Capacitate termică | 107.4 J/mol K |
| Greutatea specifică | 1.915 |
Proprietăți chimice |
|
| Inflamabilitate | Da. |
| Solubilitate în apă | 3120 g/l (la 25oC) |
| pH | 8.40 (bazic) |
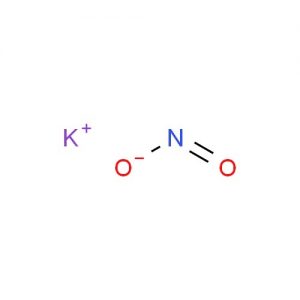
Structura nitritului de potasiu
Reacții principale
O reacție între nitritul de potasiu și acidul azotic concentrat produce nitrat de potasiu, dioxid de azot, oxid nitric și apă .
2KNO2 + 2HNO3 = 2KNO3 + NO2 + NO + H2O
O soluție saturată de KNO2 reacționează cu acidul sulfuric concentrat pentru a produce sulfat de potasiu, dioxid de azot, oxid nitric și apă .
2KNO2 + H2SO4 = K2SO4 + NO2 + NO + H2O
Nitritul de potasiu reacționează cu acidul clorhidric concentrat pentru a forma nitrat de potasiu, clorură de potasiu, oxid nitric și apă .
3KNO2 + 2HCl = KNO3 + 2KCl + 2NO + H2O
Utilizări ale nitritului de potasiu
- Pentru fabricarea altor substanțe chimice, săruri de transfer termic .
- În analiza chimică .
- Ca aditiv alimentar (conservant), în îngrășăminte .
- Ca antidot la otrăvirea cu cianură .
- Ca vasodilatator în domeniul medical .
- Ca agent anticalcar și inhibitor de coroziune .
Este periculos
Este o otravă dacă este ingerat. Poate provoca pericol de explozie dacă este încălzit. Compusul începe să se descompună la 350°C și emană vapori toxici de oxid de potasiu. KNO2 în alimente poate crește riscul de cancer .
Prețul nitritului de potasiu
10 grame de compus costă în jur de 19,2 dolari .
- Nitrit de potasiu – Pubchem.ncbi.nlm.nih.gov
- Nitrit de potasiu – Chemspider.com
- Care este pH-ul unei soluții 0,25M de nitrit de potasiu? – Quora.com
- Nitrit de potasiu – Chemicalbook.com
- Prepararea nitritului de potasiu – Prepchem.com
- Nitrit de potasiu – Chemicalbook.com
- Nitrit de potasiu reacționează cu acidul azotic – Chemiday.com
- Nitritul de potasiu reacționează cu acidul sulfuric – Chemiday.com
- Nitritul de potasiu reacționează cu clorura de hidrogen – Chemiday.com
.