Chemia Learner
Azotyn potasu reprezentowany przez wzór chemiczny KNO2 jest żółtawo-białym krystalicznym i rozpływającym się proszkiem, który jest rozpuszczalny w wodzie, alkoholu i ciekłym amoniaku. Jest solą potasową i związkiem jonowym. KNO2 jest silnym utleniaczem i jest niezgodny z silnymi kwasami, silnymi środkami redukującymi, cyjankami, solami amonowymi i materiałami łatwopalnymi.

Zazotyn potasu
Nazotyn potasu Identyfikacja |
|
| Numer CAS | 7758-09-.0 |
| PubChem CID | 516910 |
| ChemSpider ID | 22857 |
| EC Number | 231-.832-4 |
Jak go wytworzyć
Zazotyn potasu można otrzymać przez ogrzewanie azotanu potasu z ołowiem.
KNO3 + Pb = KNO2 + PbO
Jeśli chcesz, możesz użyć cynku lub miedzi zamiast ołowiu.

Wzór azotynu potasu
Właściwości i charakterystyka azotynu potasu
Właściwości ogólne |
|
| Masa molowa/masa cząsteczkowa | 85.103 g/mol |
Właściwości fizyczne |
|
| Kolor/widok | Białe lub lekko żółte kryształy |
| Punkt topnienia/kropla zamarzania | 441°C, 825.8°F |
| Punkt wrzenia | 537°C, 998.6°F |
| Gęstość | 1.9 g cm-3 |
| Stan skupienia materii w temperaturze pokojowej (faza normalna) | Ciało stałe |
| Pojemność cieplna | 107.4 J/mol K |
| Grawitacja właściwa | 1.915 |
Właściwości chemiczne |
|
| Palność | Tak |
| Rozpuszczalność w wodzie | 3120 g/l (w 25oC) |
| pH | 8.40 (zasadowy) |
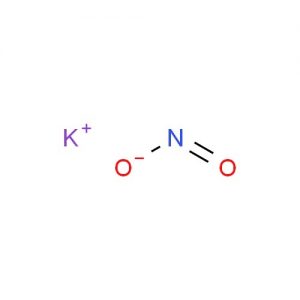
Struktura azotynu potasu
Prominentne reakcje
W wyniku reakcji azotynu potasu ze stężonym kwasem azotowym powstaje azotan potasu, dwutlenek azotu, tlenek azotu i woda .
2KNO2 + 2HNO3 = 2KNO3 + NO2 + NO + H2O
Nasycony roztwór KNO2 reaguje ze stężonym kwasem siarkowym, tworząc siarczan potasu, dwutlenek azotu, tlenek azotu i wodę .
2KNO2 + H2SO4 = K2SO4 + NO2 + NO + H2O
Atotyn potasu reaguje ze stężonym kwasem solnym tworząc azotan potasu, chlorek potasu, tlenek azotu i wodę .
3KNO2 + 2HCl = KNO3 + 2KCl + 2NO + H2O
Zastosowanie azotynu potasu
- Do wytwarzania innych związków chemicznych, soli przenoszących ciepło .
- W analizie chemicznej .
- Jako dodatek do żywności (konserwant), w nawozach .
- Jako antidotum na zatrucie cyjankiem .
- Jako środek rozszerzający naczynia krwionośne w medycynie .
- Jako środek zapobiegający osadzaniu się kamienia i inhibitor korozji .
Is It Dangerous
Jest trucizną w przypadku spożycia. Może powodować zagrożenie wybuchem w przypadku podgrzania. Związek zaczyna rozkładać się w temperaturze 350°C i wydziela toksyczne opary tlenku potasu. KNO2 w żywności może zwiększać ryzyko zachorowania na raka .
Cena azotynu potasu
10 gram związku kosztuje około 19,2$ .
- Zazotyn potasu – Pubchem.ncbi.nlm.nih.gov
- Zazotyn potasu – Chemspider.com
- Jakie jest pH 0,25M roztworu azotynu potasu? – Quora.com
- Zazotyn potasu – Chemicalbook.com
- Przygotowanie azotynu potasu – Prepchem.com
- Zazotyn potasu – Chemicalbook.com
- Zazotyn potasu reaguje z kwasem azotowym – Chemiday.com
- Reakcja azotynu potasu z kwasem siarkowym – Chemiday.com
- Reakcja azotynu potasu z chlorowodorem – Chemiday.com
.