Aprendente de Química
Nitrito de Potássio representado pela fórmula química KNO2 é um pó cristalino branco amarelado e deliquescente que é solúvel em água, álcool e amônia líquida. É um sal potássico e um composto iônico . O KNO2 é um oxidante forte e incompatível com ácidos fortes, agentes redutores fortes, cianetos, sais de amônio e materiais combustíveis .

Nitrito de Potássio
Nitrito de Potássio Identificação |
|
| Número CAS | 7758-09-0 |
| PubChem CID | 516910 |
| ChemSpider ID | 22857 |
| Número CE | 231-832-4 |
Como fazê-lo
O nitrito de potássio pode ser preparado aquecendo o nitrato de potássio com chumbo.
KNO3 + Pb = KNO2 + PbO
Se quiser, pode usar zinco ou cobre em vez de chumbo .

Fórmula de nitrito de potássio
Propriedades e características do nitrito de potássio
Propriedades gerais |
|
| Massa solar/peso molecular | 85.103 g/mol |
Propriedades físicas |
|
| Cor/Aspecto | Cristais brancos ou ligeiramente amarelos |
| Ponto de fusão/ponto de congelação | 441°C, 825.8°F |
| Ponto de congelamento | 537°C, 998.6°F |
| Densidade | 1.9 g cm-3 |
| Estado da matéria à temperatura ambiente (fase normal) | Sólido |
| Capacidade de calor | 107.4 J/mol K |
| Gravidade específica | 1.915 |
Propriedades Químicas |
|
| Flamabilidade | Sim |
| Solubilidade na água | 3120 g/l (a 25oC) |
| pH | 8.40 (básico) |
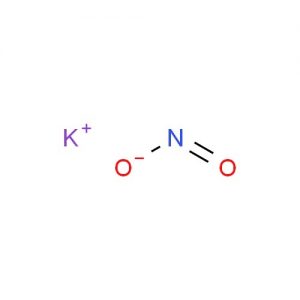
Estrutura de nitrito de potássio
Reacções proeminentes
Reacção entre nitrito de potássio e ácido nítrico concentrado produz nitrato de potássio, dióxido de azoto, óxido nítrico e água .
2KNO2 + 2HNO3 = 2KNO3 + NO2 + NO + H2O
Uma solução saturada de KNO2 reage com ácido sulfúrico concentrado para produzir sulfato de potássio, dióxido de azoto, óxido nítrico e água .
2KNO2 + H2SO4 = K2SO4 + NO2 + NO + H2O
Nitrito de potássio reage com ácido clorídrico concentrado para formar nitrato de potássio, cloreto de potássio, óxido nítrico e água .
3KNO2 + 2HCl = KNO3 + 2KCl + 2NO + H2O
Usos de nitrito de potássio
- Para fazer outros produtos químicos, sais de transferência de calor .
- Em análise química .
- Como aditivo alimentar (conservante), em fertilizantes .
- Como antídoto para o envenenamento por cianeto .
- Como um vasodilatador na área médica .
- Como um agente anti-escamação e inibidor de corrosão .
Is It Dangerous
É um veneno se ingerido. Pode causar risco de explosão se aquecido. O composto começa a decompor-se a 350°C e emite fumos tóxicos de óxido de potássio. O KNO2 nos alimentos pode aumentar o risco de cancro .
Potássio Nitrito Preço
10 gramas do composto custa cerca de $19,2 .
- Nitrito de Potássio – Pubchem.ncbi.nlm.nih.gov
- Nitrito de Potássio – Chemspider.com
- Qual é o pH de uma solução 0,25M de nitrito de potássio? – Quora.com
- Nitrito de Potássio – Chemicalbook.com
- Preparação de nitrito de potássio – Prepchem.com
- Nitrito de Potássio – Chemicalbook.com
- Nitrito de Potássio reage com ácido nítrico – Chemiday.com
- Nitrito de potássio reage com ácido sulfúrico – Chemiday.com
- Nitrito de potássio reage com cloreto de hidrogénio – Chemiday.com
>