Chemistry Learner
Kaliumnitrit representerad av den kemiska formeln KNO2 är ett vitgult kristallint och sönderflytande pulver som är lösligt i vatten, alkohol och flytande ammoniak. Det är ett kaliumsalt och en jonisk förening . KNO2 är ett starkt oxidationsmedel och oförenligt med starka syror, starka reduktionsmedel, cyanider, ammoniumsalter och brännbara material.

Kaliumnitrit
Kaliumnitrit Identifiering |
|
| CAS-nummer | 7758-09-0 |
| PubChem CID | 516910 |
| ChemSpider ID | 22857 |
| EC-nummer | 231-832-4 |
Hur man gör det
Kaliumnitrit kan framställas genom att värma kaliumnitrat med bly.
KNO3 + Pb = KNO2 + PbO
Om du vill kan du använda zink eller koppar i stället för bly .

Kaliumnitritformel
Kaliumnitritens egenskaper och kännetecken
Allmänna egenskaper |
|
| Molarmassa/molekylvikt | 85.103 g/mol |
Fysiska egenskaper |
|
| Färg/utseende | Vita eller svagt gula kristaller |
| Smältpunkt/fryspunkt | 441°C, 825.8°F |
| Kokpunkt | 537°C, 998,6°F |
| Densitet | 1.9 g cm-3 |
| Materialtillstånd vid rumstemperatur (normalfas) | Fasta ämnen |
| Värmekapacitet | 107.4 J/mol K |
| Specifik vikt | 1.915 |
Kemiska egenskaper |
|
| Brännbarhet | Ja |
| Löslighet i vatten | 3120 g/l (vid 25oC) |
| pH | 8.40 (basisk) |
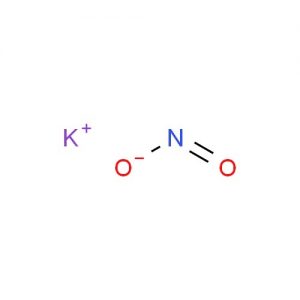
Kaliumnitrit Struktur
Prominenta reaktioner
En reaktion mellan kaliumnitrit och koncentrerad salpetersyra ger upphov till kaliumnitrat, kvävedioxid, kväveoxid och vatten .
2KNO2 + 2HNO3 = 2KNO3 + NO2 + NO + H2O
En mättad lösning av KNO2 reagerar med koncentrerad svavelsyra för att producera kaliumsulfat, kvävedioxid, kväveoxid och vatten .
2KNO2 + H2SO4 = K2SO4 + NO2 + NO + H2O
Kaliumnitrit reagerar med koncentrerad saltsyra och bildar kaliumnitrat, kaliumklorid, kväveoxid och vatten .
3KNO2 + 2HCl = KNO3 + 2KCl + 2NO + H2O
Kaliumnitrit Användning
- För att göra andra kemikalier, värmeöverföringssalter .
- I kemisk analys .
- Som livsmedelstillsats (konserveringsmedel), i gödningsmedel .
- Som motgift vid cyanidförgiftning .
- Som vasodilator inom medicinen .
- Som antikalkmedel och korrosionsinhibitor .
Är det farligt
Det är ett gift om det intas. Den kan orsaka explosionsrisk om den upphettas. Föreningen börjar sönderdelas vid 350°C och avger giftiga ångor av kaliumoxid. KNO2 i livsmedel kan öka risken för cancer .
Kaliumnitritpris
10 gram av föreningen kostar cirka 19,2 dollar .
- Kaliumnitrit – Pubchem.ncbi.nlm.nih.gov
- Kaliumnitrit – Chemspider.com
- Vad är pH-värdet för en 0,25M lösning av kaliumnitrit? – Quora.com
- Kaliumnitrit – Chemicalbook.com
- Förberedelse av kaliumnitrit – Prepchem.com
- Kaliumnitrit – Chemicalbook.com
- Kaliumnitrit reagerar med salpetersyra – Chemiday.com
- Kaliumnitrit reagerar med svavelsyra – Chemiday.com
- Kaliumnitrit reagerar med väteklorid – Chemiday.com