化学学習者
化学式 KNO2 で表される亜硝酸カリウムは、黄色がかった白い結晶と潮解性の粉末で、水、アルコール、液体アンモニアに溶ける。 カリウム塩であり、イオン性化合物である。 KNO2は強い酸化剤であり、強酸、強還元剤、シアン化物、アンモニウム塩、可燃性物質とは相容れない。

Potassium Nitrite
Potassium Nitrite Identification |
|
| CAS Number | 7758-09-…0 |
| PubChem CID | 516910 |
| ChemSpider ID | 22857 |
| EC Number | 231-…832-4 |
作り方
硝酸カリウムを鉛で加熱すると、亜硝酸カリウムを調製することができる。
KNO3 + Pb = KNO2 + PbO
望めば、鉛の代わりに亜鉛や銅を使うことができます。

亜硝酸カリウムの式
亜硝酸カリウムの性質と特徴
一般特性 |
|
| モル質量/分子量 | 85.103 g/mol |
物理的性質 |
|
| 色・外観 | 白またはわずかに黄色の結晶 |
| 融点・氷点 | 41℃、825.8°F |
| 沸点 | 537℃, 998.6°F |
| 密度 | 1.0?9 g cm-3 |
| 室温における物質の状態(順相) | 固体 |
| 熱容量 | 107.4 J/mol K |
| 比重 | 1.915 |
化学的性質 |
|
| 燃焼性 | あり |
| 水に対する溶解度 | 3120 g/l (at 25oC) |
| pH | 8.40(塩基性) |
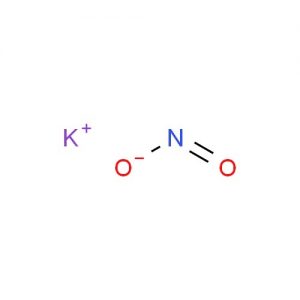
亜硝酸カリウムの構造
主な反応
亜硝酸カリウムと濃硝酸との反応により硝酸カリウム、二酸化窒素、一酸化窒素および水を生成する ……….。
2KNO2 + 2HNO3 = 2KNO3 + NO2 + NO + H2O
KNO2 の飽和溶液は濃硫酸と反応して、硫酸カリウム、二酸化窒素、一酸化窒素および水を生成する.
2KNO2 + H2SO4 = K2SO4 + NO2 + NO + H2O
亜硝酸カリウムは濃塩酸と反応して、硝酸カリウム、塩化カリウム、一酸化窒素および水を生成する.また、亜硝酸カリウムは濃塩酸と反応して、塩化カリウム、一酸化窒素および水を生成する.
3KNO2 + 2HCl = KNO3 + 2KCl + 2NO + H2O
Potassium Nitrite Uses
- To make other chemicals, heat transfer salts .
- 化学分析に .
- 食品添加物(防腐剤)、肥料に .
- 青酸中毒の解毒剤に .
- 化学分析に .
- 青酸中毒の防腐剤として .
- 血管拡張剤として医療分野 .
- スケール防止剤、腐食防止剤 .
危険性
摂取すると毒です … 続きを読む 加熱すると爆発の危険があります。 350℃で分解を開始し、有毒な酸化カリウムのガスを発生する。
Potassium Nitrite Price
10グラムで約19.2ドル。
- Potassium Nitrite – Pubchem.ncbi.nlm.nih.gov
- Potassium Nitrite – Chemspider.com
- 0.25M solution of potassium nitriteのpHは何でしょうか? – Quora.com
- 亜硝酸カリウム – Chemicalbook.com
- 亜硝酸カリウムの調製 – Prepchem.com
- Potassium Nitrite – Chemicalbook.com
- Potassium nitrite react with nitric acid – Chemiday.Com
- Notasium Nitrite – Captium Nitrite (亜硝酸カリウムの調製) – Captium Nitritite (亜硝酸カリウムの調製) – Prepchem.Comcom
- 亜硝酸カリウムは硫酸と反応する – Chemiday.com
- 亜硝酸カリウムは塩化水素と反応する – Chemiday.com