Kemi Lærer
Kaliumnitrit repræsenteret ved den kemiske formel KNO2 er et gulligt hvidt krystallinsk og deliquescent pulver, der er opløseligt i vand, alkohol og flydende ammoniak. Det er et kaliumsalt og en ionisk forbindelse . KNO2 er et stærkt oxidationsmiddel og er uforeneligt med stærke syrer, stærke reduktionsmidler, cyanider, ammoniumsalte og brændbare materialer .

Kaliumnitrit
Kaliumnitrit Identifikation |
|
| CAS-nummer | 7758-09-0 |
| PubChem CID | 516910 |
| ChemSpider ID | 22857 |
| EC-nummer | 231-832-4 |
Hvordan man laver det
Kaliumnitrit kan fremstilles ved at opvarme kaliumnitrat med bly.
KNO3 + Pb = KNO2 + PbO
Hvis du ønsker det, kan du bruge zink eller kobber i stedet for bly .

Kaliumnitrit formel
Kaliumnitritens egenskaber og karakteristika
Generelle egenskaber |
|
| Molarmasse/molekylvægt | 85.103 g/mol |
Fysiske egenskaber |
|
| Farve/udseende | Hvide eller svagt gule krystaller |
| Smeltepunkt/frysepunkt | 441°C, 825.8°F |
| Kogningspunkt | 537°C, 998,6°F |
| Tæthed | 1.9 g cm-3 |
| Materietilstand ved stuetemperatur (normal fase) | Fest |
| Varmekapacitet | 107.4 J/mol K |
| Specifik tyngdekraft | 1.915 |
Kemiske egenskaber |
|
| Brandfarlighed | Ja |
| Løselighed i vand | 3120 g/l (ved 25oC) |
| pH | |
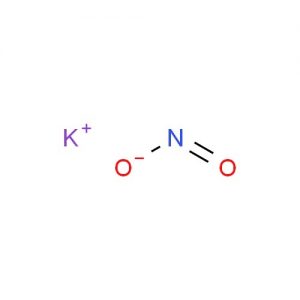
Kaliumnitrit Struktur
Prominente reaktioner
En reaktion mellem kaliumnitrit og koncentreret salpetersyre giver kaliumnitrat, nitrogendioxid, nitrogenoxid og vand .
2KNO2 + 2HNO3 = 2KNO3 + NO2 + NO + H2O
En mættet opløsning af KNO2 reagerer med koncentreret svovlsyre og danner kaliumsulfat, nitrogendioxid, nitrogenoxid og vand .
2KNO2 + H2SO4 = K2SO4 + NO2 + NO2 + NO + H2O
Kaliumnitrit reagerer med koncentreret saltsyre under dannelse af kaliumnitrat, kaliumklorid, nitrogenoxid og vand .
3KNO2 + 2HCl = KNO3 + 2KCl + 2NO + H2O
Kaliumnitrit Anvendelser
- Til fremstilling af andre kemikalier, varmeoverførselssalte .
- I kemiske analyser .
- Som tilsætningsstof til fødevarer (konserveringsmiddel), i gødning .
- Som modgift mod cyanidforgiftning .
- Som modgift mod cyanidforgiftning .
- Som vasodilator på det medicinske område .
- Som anti-kalkmiddel og korrosionsinhibitor .
Er det farligt
Det er en gift, hvis det indtages. Det kan forårsage eksplosionsfare, hvis det opvarmes. Forbindelsen begynder at nedbrydes ved 350°C og udsender giftige dampe af kaliumoxid. KNO2 i fødevarer kan øge risikoen for kræft .
Kaliumnitritpris
10 gram af forbindelsen koster omkring 19,2 dollar .
- Kaliumnitrit – Pubchem.ncbi.nlm.nih.gov
- Kaliumnitrit – Chemspider.com
- Hvad er pH-værdien af en 0,25M opløsning af kaliumnitrit? – Quora.com
- Kaliumnitrit – Chemicalbook.com
- Fremstilling af kaliumnitrit – Prepchem.com
- Kaliumnitrit – Chemicalbook.com
- Kaliumnitrit reagerer med salpetersyre – Chemiday.com
- Kaliumnitrit reagerer med svovlsyre – Chemiday.com
- Kaliumnitrit reagerer med hydrogenklorid – Chemiday.com