Chemie Learner
Kaliumnitrit mit der chemischen Formel KNO2 ist ein gelblich-weißes kristallines und zerfließendes Pulver, das in Wasser, Alkohol und flüssigem Ammoniak löslich ist. Es ist ein Kaliumsalz und eine ionische Verbindung. KNO2 ist ein starkes Oxidationsmittel und unverträglich mit starken Säuren, starken Reduktionsmitteln, Cyaniden, Ammoniumsalzen und brennbaren Materialien .

Kaliumnitrit
Kaliumnitrit Kennzeichnung |
|
| CAS-Nummer | 7758-09-0 |
| PubChem CID | 516910 |
| ChemSpider ID | 22857 |
| EC Nummer | 231-832-4 |
Wie man es herstellt
Kaliumnitrit kann durch Erhitzen von Kaliumnitrat mit Blei hergestellt werden.
KNO3 + Pb = KNO2 + PbO
Wenn man will, kann man statt Blei auch Zink oder Kupfer verwenden.

Kaliumnitrit Formel
Eigenschaften und Merkmale von Kaliumnitrit
Allgemeine Eigenschaften |
|
| Molmasse/Molekulargewicht | 85.103 g/mol |
Physikalische Eigenschaften |
|
| Farbe/Aussehen | Weiße oder leicht gelbe Kristalle |
| Schmelzpunkt/Gefrierpunkt | 441°C, 825.8°F |
| Siedepunkt | 537°C, 998.6°F |
| Dichte | 1.9 g cm-3 |
| Zustand der Materie bei Raumtemperatur (Normalphase) | fest |
| Wärmekapazität | 107.4 J/mol K |
| Spezifische Schwerkraft | 1.915 |
Chemische Eigenschaften |
|
| Entzündbarkeit | Ja |
| Löslichkeit in Wasser | 3120 g/l (bei 25oC) |
| pH | 8.40 (basisch) |
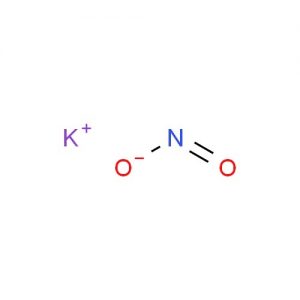
Kaliumnitrit Struktur
Einschlägige Reaktionen
Bei der Reaktion zwischen Kaliumnitrit und konzentrierter Salpetersäure entstehen Kaliumnitrat, Stickstoffdioxid, Stickstoffoxid und Wasser .
2KNO2 + 2HNO3 = 2KNO3 + NO2 + NO + H2O
Eine gesättigte Lösung von KNO2 reagiert mit konzentrierter Schwefelsäure unter Bildung von Kaliumsulfat, Stickstoffdioxid, Stickstoffoxid und Wasser .
2KNO2 + H2SO4 = K2SO4 + NO2 + NO + H2O
Kaliumnitrit reagiert mit konzentrierter Salzsäure unter Bildung von Kaliumnitrat, Kaliumchlorid, Stickstoffoxid und Wasser .
3KNO2 + 2HCl = KNO3 + 2KCl + 2NO + H2O
Verwendung von Kaliumnitrit
- Zur Herstellung anderer Chemikalien, Wärmeübertragungssalze .
- In der chemischen Analyse .
- Als Lebensmittelzusatzstoff (Konservierungsmittel), in Düngemitteln .
- Als Gegenmittel bei Zyanidvergiftungen .
- Als Vasodilatator in der Medizin .
- Als Anti-Kalk-Mittel und Korrosionsinhibitor .
Ist es gefährlich
Es ist ein Gift, wenn es eingenommen wird. Es kann bei Erhitzung eine Explosionsgefahr darstellen. Die Verbindung beginnt sich bei 350°C zu zersetzen und setzt giftige Dämpfe aus Kaliumoxid frei. KNO2 in Lebensmitteln kann das Krebsrisiko erhöhen.
Kaliumnitrit Preis
10 Gramm der Verbindung kosten etwa $19,2 .
- Kaliumnitrit – Pubchem.ncbi.nlm.nih.gov
- Kaliumnitrit – Chemspider.com
- Was ist der pH-Wert einer 0,25M Lösung von Kaliumnitrit? – Quora.com
- Kaliumnitrit – Chemicalbook.com
- Zubereitung von Kaliumnitrit – Prepchem.com
- Kaliumnitrit – Chemicalbook.com
- Kaliumnitrit reagiert mit Salpetersäure – Chemiday.com
- Kaliumnitrit reagieren mit Schwefelsäure – Chemiday.com
- Kaliumnitrit reagieren mit Chlorwasserstoff – Chemiday.com