Chemistry Learner
Il nitrito di potassio rappresentato dalla formula chimica KNO2 è una polvere cristallina bianca giallastra e deliquescente che è solubile in acqua, alcol e ammoniaca liquida. È un sale di potassio e un composto ionico. KNO2 è un forte ossidante e incompatibile con acidi forti, agenti riducenti forti, cianuri, sali di ammonio e materiali combustibili.

Nitrito di potassio
Identificazione nitrito di potassio |
|
| Numero CAS | 7758-09-0 |
| PubChem CID | 516910 |
| ChemSpider ID | 22857 |
| Numero CE | 231-832-4 |
Come si fa
Il nitrito di potassio può essere preparato riscaldando il nitrato di potassio con il piombo.
KNO3 + Pb = KNO2 + PbO
Se vuoi, puoi usare zinco o rame invece di piombo.

Formula del nitrito di potassio
Proprietà e caratteristiche del nitrito di potassio
Proprietà generali |
|
| Massa molecolare/peso molecolare | 85.103 g/mol |
Proprietà fisiche |
|
| Colore/aspetto | Cristalli bianchi o leggermente gialli |
| Punto di fusione/di congelamento | 441°C, 825.8°F |
| Punto di ebollizione | 537°C, 998.6°F |
| Densità | 1.9 g cm-3 |
| Stato della materia a temperatura ambiente (fase normale) | Solido |
| Capacità termica | 107.4 J/mol K |
| Gravità specifica | 1.915 |
Proprietà chimiche |
|
| Infiammabilità | Sì |
| Solubilità in acqua | 3120 g/l (a 25oC) |
| pH | 8.40 (basico) |
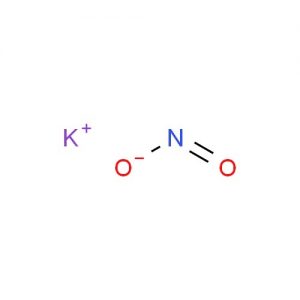
Struttura del nitrito di potassio
Reazioni probabili
La reazione tra nitrito di potassio e acido nitrico concentrato produce nitrato di potassio, biossido di azoto, ossido nitrico e acqua.
2KNO2 + 2HNO3 = 2KNO3 + NO2 + NO + H2O
Una soluzione satura di KNO2 reagisce con acido solforico concentrato per produrre solfato di potassio, biossido di azoto, ossido nitrico e acqua.
2KNO2 + H2SO4 = K2SO4 + NO2 + NO + H2O
Il nitrito di potassio reagisce con acido cloridrico concentrato per formare nitrato di potassio, cloruro di potassio, ossido nitrico e acqua .
3KNO2 + 2HCl = KNO3 + 2KCl + 2NO + H2O
Usi del nitrito di potassio
- Per fare altri prodotti chimici, sali di trasferimento di calore .
- In analisi chimica .
- Come additivo alimentare (conservante), nei fertilizzanti .
- Come antidoto all’avvelenamento da cianuro .
- Come vasodilatatore in campo medico.
- Come agente anticalcare e inibitore di corrosione.
È pericoloso
È un veleno se ingerito. Può causare pericolo di esplosione se riscaldato. Il composto inizia a decomporsi a 350°C ed emette fumi tossici di ossido di potassio. KNO2 nel cibo può aumentare il rischio di cancro.
Prezzo del nitrito di potassio
10 grammi del composto costano circa 19,2 dollari.
- Nitrito di potassio – Pubchem.ncbi.nlm.nih.gov
- Nitrito di potassio – Chemspider.com
- Qual è il pH di una soluzione 0,25M di nitrito di potassio? – Quora.com
- Nitrito di potassio – Chemicalbook.com
- Preparazione di nitrito di potassio – Prepchem.com
- Nitrito di potassio – Chemicalbook.com
- Nitrito di potassio reagire con acido nitrico – Chemiday.com
- Il nitrito di potassio reagisce con acido solforico – Chemiday.com
- Il nitrito di potassio reagisce con cloruro di idrogeno – Chemiday.com