Apprentissage de la chimie
Le nitrite de potassium représenté par la formule chimique KNO2 est une poudre cristalline blanc jaunâtre et déliquescente qui est soluble dans l’eau, l’alcool et l’ammoniac liquide . C’est un sel de potassium et un composé ionique. KNO2 est un oxydant fort et incompatible avec les acides forts, les agents réducteurs forts, les cyanures, les sels d’ammonium et les matières combustibles .

Nitrite de potassium
Nitrite de potassium Identification |
|
| Numéro CAS | 7758-09-.0 |
| PubChem CID | 516910 |
| ChemSpider ID | 22857 |
| Numéro CE | 231-832-4 |
Comment le fabriquer
Le nitrite de potassium peut être préparé en chauffant du nitrate de potassium avec du plomb.
KNO3 + Pb = KNO2 + PbO
Si vous voulez, vous pouvez utiliser du zinc ou du cuivre à la place du plomb .

Formule du nitrite de potassium
Propriétés et caractéristiques du nitrite de potassium
Propriétés générales |
|
| Masse molaire/poids moléculaire | 85.103 g/mol |
Propriétés physiques |
|
| Couleur/apparence | Cristaux blancs ou légèrement jaunes |
| Point de fusion/point de congélation | 441°C, 825.8°F |
| Point d’ébullition | 537°C, 998.6°F |
| Densité | 1.9 g cm-3 |
| État de la matière à température ambiante (phase normale) | Solide |
| Capacité calorifique | 107.4 J/mol K |
| Gravité spécifique | 1.915 |
Propriétés chimiques |
|
| Inflammabilité | Oui. |
| Solubilité dans l’eau | 3120 g/l (à 25oC) |
| pH | 8.40 (basique) |
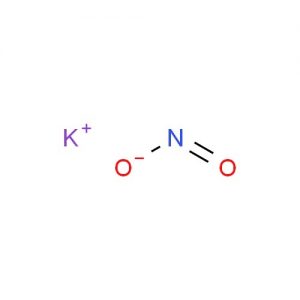
Structure du nitrite de potassium
Réactions marquantes
Une réaction entre le nitrite de potassium et l’acide nitrique concentré produit du nitrate de potassium, du dioxyde d’azote, du monoxyde d’azote et de l’eau .
2KNO2 + 2HNO3 = 2KNO3 + NO2 + NO + H2O
Une solution saturée de KNO2 réagit avec de l’acide sulfurique concentré pour produire du sulfate de potassium, du dioxyde d’azote, de l’oxyde nitrique et de l’eau .
2KNO2 + H2SO4 = K2SO4 + NO2 + NO + H2O
Le nitrite de potassium réagit avec l’acide chlorhydrique concentré pour former du nitrate de potassium, du chlorure de potassium, de l’oxyde nitrique et de l’eau .
3KNO2 + 2HCl = KNO3 + 2KCl + 2NO + H2O
Utilisations du nitrite de potassium
- Pour fabriquer d’autres produits chimiques, des sels de transfert thermique .
- En analyse chimique .
- Comme additif alimentaire (conservateur), dans les engrais .
- Comme antidote à l’empoisonnement au cyanure .
- Comme vasodilatateur dans le domaine médical .
- Comme agent anti-calcaire et inhibiteur de corrosion .
Est-il dangereux
C’est un poison s’il est ingéré. Il peut provoquer un risque d’explosion s’il est chauffé. Le composé commence à se décomposer à 350°C et émet des fumées toxiques d’oxyde de potassium. KNO2 dans les aliments peut augmenter le risque de cancer .
Prix du nitrite de potassium
10 grammes du composé coûte environ 19,2 $ .
- Nitrite de potassium – Pubchem.ncbi.nlm.nih.gov
- Nitrite de potassium – Chemspider.com
- Quel est le pH d’une solution 0,25M de nitrite de potassium ? – Quora.com
- Nitrite de potassium – Chemicalbook.com
- Préparation du nitrite de potassium – Prepchem.com
- Nitrite de potassium – Chemicalbook.com
- Nitrite de potassium réagit avec l’acide nitrique – Chemiday.com
- Le nitrite de potassium réagit avec l’acide sulfurique – Chemiday.com
- Le nitrite de potassium réagit avec le chlorure d’hydrogène – Chemiday.com
.