Kemian oppija
Kemiallista kaavaa KNO2 edustava kaliumnitriitti on kellertävän valkoinen kiteinen ja juokseva jauhe, joka liukenee veteen, alkoholiin ja nestemäiseen ammoniakkiin . Se on kaliumsuola ja ioniyhdiste . KNO2 on voimakas hapetin ja yhteensopimaton voimakkaiden happojen, voimakkaiden pelkistimien, syanidien, ammoniumsuolojen ja palavien aineiden kanssa .

Kaliumnitriitti
Kaliumnitriitin tunnistetiedot |
|
| CAS-numero | 7758-09-0 |
| PubChem CID | 516910 |
| ChemSpider ID | 22857 |
| EC Number | 231-832-4 |
Miten sitä valmistetaan
Kaliumnitriittiä voidaan valmistaa kuumentamalla kaliumnitraattia lyijyllä.
KNO3 + Pb = KNO2 + PbO
Voit halutessasi käyttää lyijyn sijasta sinkkiä tai kuparia .

Kaliumnitriitin kaava
Kaliumnitriitin ominaisuudet ja ominaisuudet
Yleisominaisuudet |
|
| Molaarinen massa/molekyylipaino | 85.103 g/mol |
Fysikaaliset ominaisuudet |
|
| Väri/ulkonäkö | Valkoisia tai lievästi keltaisia kiteitä |
| Sulamispiste/jäätymispiste | 441°C, 825.8°F |
| Kiehumispiste | 537°C, 998.6°F |
| Tiheys | 1.9 g cm-3 |
| Aineen olomuoto huoneenlämmössä (normaalifaasi) | Kiinteä |
| Lämpökapasiteetti | 107.4 J/mol K |
| Ominaispaino | 1.915 |
Kemialliset ominaisuudet |
|
| Syttyvyys | Kyllä. |
| Liukoisuus veteen | 3120 g/l (25oC:ssa) |
| pH | 8.40 (emäksinen) |
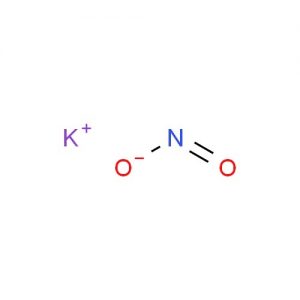
Kaliumnitriitin rakenne
Tärkeitä reaktioita
Kaliumnitriitin ja väkevän typpihapon välisessä reaktiossa syntyy kaliumnitraattia, typpidioksidia, typpioksidia ja vettä .
2KNO2 + 2HNO3 = 2KNO3 + NO2 + NO + NO + H2O
Kyllästetty KNO2-liuos reagoi väkevän rikkihapon kanssa tuottaen kaliumsulfaattia, typpidioksidia, typpioksidia ja vettä .
2KNO2 + H2SO4 = K2SO4 + NO2 + NO + NO + H2O
Kaliumnitriitti reagoi väkevän suolahapon kanssa muodostaen kaliumnitraattia, kaliumkloridia, typpioksidia ja vettä .
3KNO2 + 2HCl = KNO3 + 2KCl + 2NO + H2O
Kaliumnitriitin käyttökohteet
- Muiden kemikaalien valmistukseen, lämmönsiirtosuolat .
- Kemiallisessa analyysissä .
- Elintarvikkeiden lisäaineena (säilöntäaineena), lannoitteissa .
- Syanidimyrkytyksen vastalääkkeenä .
- Vaskodilataattorina lääketieteen alalla .
- Korroosionestoaineena ja korroosionestoaineena .
Onko se vaarallista
Se on myrkkyä nieltynä. Se voi aiheuttaa räjähdysvaaran kuumennettaessa. Yhdiste alkaa hajota 350°C:ssa ja vapauttaa myrkyllisiä kaliumoksidihuuruja. KNO2 elintarvikkeissa voi lisätä syöpäriskiä .
Kaliumnitriitin hinta
10 grammaa yhdistettä maksaa noin 19,2 dollaria .
- Kaliumnitriitti – Pubchem.ncbi.nlm.nih.gov
- Kaliumnitriitti – Chemspider.com
- Mikä on kaliumnitriitin 0,25M liuoksen pH? – Quora.com
- Kaliumnitriitti – Chemicalbook.com
- Kaliumnitriitin valmistus – Prepchem.com
- Kaliumnitriitti – Chemicalbook.com
- Kaliumnitriitti reagoi typpihapon kanssa – Chemiday.com
- Kaliumnitriitti reagoi rikkihapon kanssa – Chemiday.com
- Kaliumnitriitti reagoi vetykloridin kanssa – Chemiday.com