Aprendiz de Química
El nitrito de potasio representado por la fórmula química KNO2 es un polvo cristalino blanco amarillento y delicuescente que es soluble en agua, alcohol y amoníaco líquido. Es una sal de potasio y un compuesto iónico. El KNO2 es un oxidante fuerte e incompatible con ácidos fuertes, agentes reductores fuertes, cianuros, sales de amonio y materiales combustibles.

Nitrito de potasio
Identificación del nitrito de potasio |
|
| Número CAS | 7758-09-0 |
| PubChem CID | 516910 |
| ChemSpider ID | 22857 |
| Número CE | 231-832-4 |
Cómo se hace
El nitrito de potasio puede prepararse calentando nitrato de potasio con plomo.
KNO3 + Pb = KNO2 + PbO
Si quieres, puedes utilizar zinc o cobre en lugar de plomo .

Fórmula del nitrito de potasio
Propiedades y características del nitrito de potasio
Propiedades generales |
|
| Masa molecular/peso molecular | 85.103 g/mol |
Propiedades físicas |
|
| Color/apariencia | |
| Punto de fusión/punto de congelación | |
| Punto de ebullición | 537°C, 998.6°F |
| Densidad | |
| Estado de la materia a temperatura ambiente (fase normal) | Sólido |
| Capacidad calorífica | |
| Gravedad específica | 1.915 |
Propiedades químicas |
|
| Inflamabilidad | Sí |
| Solubilidad en agua | 3120 g/l (a 25oC) |
| pH | 8.40 (básico) |
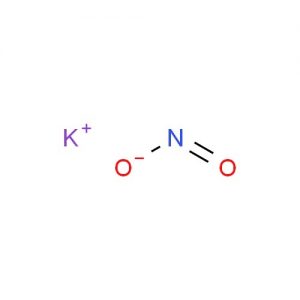
Estructura del Nitrito de Potasio
Reacciones más frecuentes
Una reacción entre el nitrito de potasio y el ácido nítrico concentrado produce nitrato de potasio, dióxido de nitrógeno, óxido nítrico y agua .
2KNO2 + 2HNO3 = 2KNO3 + NO2 + NO + H2O
Una solución saturada de KNO2 reacciona con ácido sulfúrico concentrado para producir sulfato de potasio, dióxido de nitrógeno, óxido nítrico y agua .
2KNO2 + H2SO4 = K2SO4 + NO2 + NO + H2O
El nitrito de potasio reacciona con el ácido clorhídrico concentrado para formar nitrato de potasio, cloruro de potasio, óxido nítrico y agua .
3KNO2 + 2HCl = KNO3 + 2KCl + 2NO + H2O
Usos del nitrito de potasio
- Para hacer otros productos químicos, sales de transferencia de calor .
- En análisis químicos .
- Como aditivo alimentario (conservante), en fertilizantes .
- Como antídoto para la intoxicación por cianuro .
- Como vasodilatador en el ámbito médico .
- Como agente anticalcáreo e inhibidor de la corrosión .
Es peligroso
Es un veneno si se ingiere. Puede causar peligro de explosión si se calienta. El compuesto comienza a descomponerse a 350°C y emite humos tóxicos de óxido de potasio. El KNO2 en los alimentos puede aumentar el riesgo de cáncer.
Precio del nitrito de potasio
10 gramos del compuesto cuestan alrededor de 19,2 dólares.
- Nitrito de Potasio – Pubchem.ncbi.nlm.nih.gov
- Nitrito de Potasio – Chemspider.com
- ¿Cuál es el pH de una solución 0,25M de nitrito de potasio? – Quora.com
- Nitrito de potasio – Chemicalbook.com
- Preparación de nitrito de potasio – Prepchem.com
- Nitrito de potasio – Chemicalbook.com
- Nitrito de potasio reacciona con ácido nítrico – Chemiday.com
- Nitrito de potasio reacciona con ácido sulfúrico – Chemiday.com
- Nitrito de potasio reacciona con cloruro de hidrógeno – Chemiday.com