Frontiers in Genetics
Úvod
Mnoho znaků je regulováno a koordinováno více geny a podmínkami prostředí. V přírodě se tyto znaky neustále vyvíjejí pod lokálními selekčními tlaky a neutrálními procesy, což vede k bohaté rozmanitosti fenotypových odrůd a strategií vyrovnávání se s prostředím. Již Dobzhansky (1964) popsal bohatou rozmanitost v živém světě jako výsledek genetické rozmanitosti, heterogenity prostředí a adaptací, které se vyvíjejí při vzájemném působení molekulární a organismální biologie. Molekulární mechanismy v evoluci bylo obzvláště obtížné charakterizovat. Nejprve je třeba propojit genotyp s fenotypem. Toto spojení tvoří rozsáhlé a složité sítě genových interakcí (Ayroles et al., 2009; Lehner, 2013). Zadruhé musíme identifikovat molekulární změny zodpovědné za fenotypové adaptace. To závisí na objasnění genetické variability a genetických změn, které se mohou vyskytovat kdekoli v sítích genových interakcí (např. Edwards et al., 2009).
Projevy genetické variability v genových sítích jsou velmi složité. Změny v jednotlivých genech mohou ovlivnit aktivitu a dokonce i topologii celé genetické sítě (např. Knight et al., 2006). Geny a sítě genových interakcí jsou často pleiotropní a regulují různé znaky a procesy, což znamená, že změny v jednom genu se mohou projevit v několika znacích (Stearns, 2010). A naopak, alelické změny v mnoha genech mohou přispívat k variabilitě určitého fenotypového znaku (Manolio et al., 2009). Kromě toho je epistáze všudypřítomná, což znamená, že alelické variace ve více lokusech mohou vzájemně ovlivňovat fenotypové účinky (Phillips, 2008; Mackay a Moore, 2014; Moore a Williams, 2015). Tyto úvahy o genetickém základu evoluce nejsou nové a studují se již několik desetiletí (např. Wagner a Altenberg, 1996). Forward a reverzní genetika byly velmi úspěšné při objasňování funkcí jednotlivých genů nebo mutací pro určitý znak (Nagy et al., 2003). Tyto techniky jsou však limitující při studiu složitosti molekulárních interakčních sítí, které jsou základem fenotypu, nebo molekulárních mechanismů evoluce komplexních znaků.
Vývoj genomických technologií byl významným impulsem pro naši schopnost studovat genetickou složitost fenotypových znaků a jejich evoluci (Stapley et al., 2010). Kombinace těchto technik s klasickými genetickými přístupy nám umožňuje posoudit funkčnost genetické variability pro fenotypové znaky (Storz a Wheat, 2010). První genomické studie na několika modelových organismech zdůraznily, že evoluční adaptace, a to i pro specifické podmínky prostředí, obecně řídí mnoho genů nebo lokusů, stejně jako dynamickou regulaci vzorců genové exprese (Gasch a kol., 2000; Fay a kol., 2004; Pedra a kol., 2004). V následujícím desetiletí využilo mnoho studií genomiku k identifikaci genů a proteinů, které přispívají k určitým znakům a ekologickým interakcím. Zpočátku byly náklady a čas potřebný k sekvenování jednoho genomu stále velmi omezující. Sekvenování nové generace však umožnilo sekvenovat genomy mnohem více druhů a mnohem více jedinců jednotlivých druhů. To je pro studium evoluce ohromný zdroj, protože nám poprvé umožňuje mapovat změny v celém genomu během evoluce.
Genomická technologie má obrovský potenciál zlepšit náš pohled na evoluční procesy. Srovnávací přístupy byly použity k mapování změn v sekvencích genomu nebo v sítích genových interakcí v dlouhých časových horizontech evoluce (Drosophila 12 Genomes Consortium et al., 2007; Nowick et al., 2009; Jones et al., 2012). Přístupy experimentální selekce nebo experimentální evoluce následované transkriptomikou nebo sekvenováním genomu byly použity k mapování evolučních změn v mnohem kratších časových měřítkách (Hunt et al., 2010; Turner et al., 2011; Wertheim et al., 2011; Tenaillon et al., 2012; Linnen et al., 2013; Jalvingh et al., 2014). Tyto studie například ukázaly, jak mohou mít genové duplikace, mutace a silná sekvenční divergence v malé podskupině genů zásadní vliv na transkripční aktivitu rozsáhlých sítí genových interakcí a mnohočetné fenotypové znaky.
V tomto pohledu představuji nejnovější poznatky a vývoj v oblasti genomických základů evoluce na příkladu vyvíjející se imunity. Imunita je znak, který se rychle vyvíjí, takže je vhodný ke studiu genomického základu evolučních procesů (Obbard et al., 2009; Sironi et al., 2015). Molekulární sítě v imunitě jsou navíc poměrně dobře charakterizovány vzhledem k jejich významu pro lidské zdraví (Schadt, 2009; Lazzaro a Schneider, 2014; Zak et al., 2014). Nejprve velmi stručně shrnu naše současné poznatky o molekulárních sítích vrozené imunity a selekčních procesech, které působí na imunitní odpovědi. Poté popisuji genomické změny, které souvisejí se ziskem, ztrátou a modulací jednotlivých aspektů imunitních reakcí u drozofily. Finally, I propose future directions to study the genetic architecture of complex traits and evolutionary processes.
Imunitní reakce
Imunitní systém se skládá z kombinace fyziologických procesů, které společně působí při obraně proti patogenům a parazitům. Vrozená imunita je prastará vlastnost, kterou lze nalézt u všech mnohobuněčných organismů, zatímco obratlovci mají také imunitu získanou. Oba imunitní systémy kombinují buněčnou a humorální složku: buněčná složka zahrnuje specializované buňky, které zajišťují ochrannou funkci. Patří sem třídy krevních buněk pro fagocytózu mikrobů, opouzdření větších cizích těles nebo rozpoznávání antigenů (u získané imunity) a výstelka střeva s epitelovými buňkami, které tvoří fyzickou bariéru a mohou vylučovat obranné látky. Humorální složka spočívá v uvolňování extracelulárních faktorů, které bojují proti napadajícím patogenům, často ze specializovaných tkání nebo buněčných populací. Patří sem uvolňování antimikrobiálních peptidů (AMP) játry (nebo tukovým tělesem u bezobratlých) a střevními epiteliálními buňkami, reaktivní formy kyslíku ve fagocytujících a epiteliálních buňkách a protilátky z bílých krvinek (u získané imunity; Lemaitre a Hoffmann, 2007; Buchmann, 2014).
Komplexní sítě molekulárních interakcí koordinují imunitní odpovědi (obr. 1A). Stejné dráhy jsou ústředním prvkem imunitních reakcí od bezobratlých až po obratlovce, což znamená silné zachování základních prvků molekulárních sítí v imunitě (Silverman a Maniatis, 2001; Evans et al., 2003; Buchmann, 2014). Různé receptorové molekuly mohou rozpoznávat patogeny nebo parazity, například na základě molekulárních vzorů asociovaných s patogenem (např. lipopolysacharidy specifické pro bakteriální membrány). Jakmile jsou receptory aktivovány, indukují specifické signální transdukční dráhy, jako jsou dráhy Toll, Imd a Jak/Stat (přehled v Lemaitre a Hoffmann, 2007; Buchmann, 2014). Tyto dráhy se skládají z proteáz, kináz, cytokinů a dalších proteinů, které nakonec aktivují transkripční faktory a kofaktory. Indukce těchto transkripčních faktorů vede k produkci humorálních efektorových molekul (např. AMP) a může vyvolat proliferaci a diferenciaci buněk zapojených do imunity. Produkce různých tříd krevních buněk je významným aspektem buněčné složky imunitní odpovědi, a to jak u vrozené, tak u získané imunity. V těchto krevních buňkách jsou také regulovány signální transdukční kaskády, které indukují buněčné vlastnosti a proteiny, které účinně odstraňují parazita. Pro regulaci síly, specifičnosti, načasování a trvání imunitních odpovědí jsou molekulární sítě modulovány cytokiny, proteázami a křížovými vazbami s jinými signálními drahami (Liew et al., 2005; Aggarwal a Silverman, 2008). Patří sem také rozmanité posttranskripční regulační sítě (Ivanov a Anderson, 2013; Carpenter a kol., 2014).
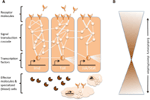
Obrázek 1. Síť imunitního systému. Schematické znázornění genetických sítí v imunitě. (A) Několik vzájemně propojených sítí koordinuje odpovědi na imunitní výzvu. Tyto sítě se skládají z proteinů (znázorněných kroužky), které spolu interagují v signální transdukční kaskádě a regulují expresi transkripčních faktorů (znázorněných šestiúhelníky). Aktivace základních signálních transdukčních drah (např. IMD, Toll nebo Jak/Stat, označené tlustými čarami mezi proteiny) vede k produkci efektorových molekul, jako jsou antimikrobiální peptidy (znázorněné symboly ve tvaru koláče), a k proliferaci a diferenciaci specializovaných (krevních) buněk (obrázky ve tvaru obláčku). Extracelulární a membránové receptorové molekuly (obrázky ve tvaru měsíce) indukují tyto dráhy. Aktivita může být dále modulována mnoha dalšími proteiny, které interagují s dráhami a vzájemně se ovlivňují s jinými dráhami a genetickými sítěmi (naznačeno tenkými čarami mezi proteiny). (B) Ústřední složky genetických sítí v imunitě, např. transkripční faktory a proteiny v přímém kontaktu s těmito transkripčními faktory, jsou často silně konzervovány napříč fyly. Evoluční diverzifikace se vyskytuje ve větší míře směrem k periferiím těchto sítí.
Hnacími silami evolučních změn v imunitních reakcích jsou kombinované účinky vysokých fitness nákladů infekce pro hostitele, nákladů imunity, bohaté diverzity patogenů a parazitů, kteří ohrožují hostitele, a dynamických koevolučních závodů ve zbrojení mezi hostiteli a patogeny (Schmid-Hempel, 2003). Kterýkoli z těchto aspektů nebo všechny tyto aspekty mohou působit v místním prostředí hostitele a vést k silným selekčním tlakům. Typ selekce se však liší od směrové přes očistnou až po vyrovnávací v závislosti na nákladech a výnosech, které hostitelská populace ve svém místním prostředí zažívá. Například vysoce virulentní patogen, který napadne místní komunitu, může způsobit selekční zásah nebo směrovou selekci pro určité alely rezistence, protože pouze hostitelé s těmito alelami mohou přispívat do dalších generací. Alternativně může rozmanité nebo společně se vyvíjející společenství patogenů vyvolat selekci závislou na frekvenci nebo vyrovnávací selekci, která podporuje zachování genetické variability. Evoluce imunitních reakcí odráží jak tuto koevoluční dynamiku s parazitem, tak fyziologické a ekologické náklady imunitního systému (Kraaijeveld et al., 2002; Rolff a Siva-Jothy, 2003; Schmid-Hempel, 2005; Lazzaro a Little, 2009).
Genomické základy evolučních změn v imunitě drozofil
Zatímco centrální mechanismus imunitních reakcí je silně konzervovaný, několik složek rozšířených molekulárních sítí se může rychle vyvíjet nebo diverzifikovat (obrázek 1B). U drozofily byly rychlé evoluční změny zaznamenány u receptorů a efektorů imunitní odpovědi (Sackton et al., 2007; Obbard et al., 2009; Salazar-Jaramillo et al., 2014). Tyto molekuly působí na rozhraní mezi hostitelem a patogenem, a jsou proto klíčové pro rozpoznání invazního organismu hostitelem a pro zprostředkování cílení a antagonistických účinků imunitní odpovědi na patogen. Současně probíhá selekce parazita, aby zůstal neodhalen a vyhnul se antagonistickým účinkům imunitní odpovědi nebo je zmírnil. Proto se u těchto molekul na rozhraní a u těch, které modulují imunitní reakce, očekává dynamika Červené královny. Každá ze stran se snaží získat převahu v antagonistických závodech ve zbrojení, což recipročně vede ke změnám v genetických sítích obou stran. Diverzifikace v receptorových, modulátorových a efektorových molekulách probíhá většinou pomocí genových duplikací a rychlých sekvenčních změn (Drosophila 12 Genomes Consortium et al., 2007; Sackton et al., 2007; Salazar-Jaramillo et al., 2014).
Studovali jsme imunitní odpověď drozofily proti parazitoidním vosičkám jako modelový systém pro pochopení genomického základu evolučních procesů. Larvy drozofil jsou hostiteli různých druhů parazitoidů, kteří do těchto larev kladou vajíčka (Fleury et al., 2009). Jakmile se vajíčko parazitoida vylíhne (∼2-4 dny po napadení parazitoidem, v závislosti na druhu parazitoida a teplotě), larva parazitoida se začne živit hostitelem a usmrtí ho. Některé druhy drozofil mají obranný mechanismus proti parazitoidům prostřednictvím vrozené imunitní reakce, tzv. melanotického opouzdření. Tato imunitní odpověď se skládá z buněčných a humorálních složek, které společně působí na zachycení a usmrcení vajíčka parazitoida. Útok parazitoidů spouští imunitní signální přenosové cesty, které indukují (i) proliferaci a diferenciaci dvou tříd hemocytů (tj. krevních buněk hmyzu), které přilnou k vajíčku parazitoida a k sobě navzájem, a (ii) ukládání melaninu na vajíčko parazitoida a buněčné pouzdro kolem vajíčka parazitoida (Lemaitre a Hoffmann, 2007). Aby hostitel přežil napadení parazitoidy, musí dokončit úplné opouzdření a melanizaci ještě před vylíhnutím vajíčka parazitoida.
Před érou genomiky bylo identifikováno několik genů, které se podílely na imunitní odpovědi proti parazitoidním vosičkám. Byly identifikovány dráhy Toll a Jak/Stat jako ústřední složky proliferace a diferenciace hemocytů a dráha profenoloxidázy pro melanizaci (přehled v Brennan a Anderson, 2004). Poté byly provedeny dvě mikroarray studie s cílem identifikovat další geny potenciálně zapojené do melanotického opouzdření po napadení parazitoidy. Tento přístup poukázal na mnoho dalších genů, které dosud nebyly spojovány s imunitní odpovědí proti parazitoidům, a odhalil dobu jejich působení (Wertheim et al., 2005; Schlenke et al., 2007). Studie odhalily několik koordinovaných a funkčně koherentních shluků genů, které byly během části imunitní odpovědi dočasně zvýšeny nebo sníženy (Wertheim et al., 2005). Zajímavé bylo, že se ukázalo, že mechanismy virulence dvou druhů parazitoidů se lišily v tom, jak zasahovaly do genetické sítě hostitelských odpovědí: jeden druh eliminoval počáteční aktivaci celé sítě, zatímco jiný druh se zaměřil na poslední krok kaskády (Schlenke et al., 2007).
Druhy Drosophila se do značné míry liší v imunitě proti parazitoidům. Některé druhy jsou vůči parazitoidům zcela citlivé, což bylo popsáno jako imunodeficit (Eslin a Doury, 2006). Bližší zkoumání však ukázalo, že rezistence vůči parazitoidům není společná všem druhům Drosophila, ale je omezena na několik kladů. Ukázali jsme, že v jednom z těchto kladů, podskupině melanogaster, byl evoluční zisk rezistence vůči parazitoidům spojen se ziskem nového typu krevních buněk, lamelocytů, který je rovněž omezen na stejný klad (Salazar-Jaramillo et al., 2014). Některé druhy drozofil mimo podskupinu melanogaster mohou také enkapsulovat vajíčka parazitoidů, ale zdá se, že se u nich vyvinuly jiné typy krevních buněk pro enkapsulační reakci (Havard et al., 2012; Márkus et al., 2015). Imunitní odpověď proti parazitoidům se u různých hmyzích taxonů vyvinula nezávisle, často s mírně odlišnými mechanismy a typy krevních buněk (Lavine a Strand, 2002). Evoluce vrozeného imunitního systému tedy zahrnuje přidávání nových složek nebo „modulů“. To vyvolává otázku, jak se mění genom při získávání nového modulu.
Srovnávací genomika odhalila, že navzdory zisku nového typu krevní buňky u podskupiny melanogaster jsou geny, které jsou známé pro diferenciaci lamelocytů, z velké části zachovány napříč celou fylogenezí. Také druhy, které neprodukují lamelocyty v reakci na útok parazitoidů, mají tyto geny potřebné pro diferenciaci lamelocytů. Navíc tyto geny vykazují malou divergenci nebo známky selekce, zatímco to by se dalo očekávat u genů, které získaly novou funkci. To naznačuje, že stávající signální transdukční dráhy pro diferenciaci hemocytů jsou modulovány okolní sítí genových interakcí k produkci nového typu krevních buněk v podskupině melanogaster. Této kooptace stávající základní dráhy proliferace hemocytů je pravděpodobně dosaženo přidáním dalších nebo nových komponent do sítě genových interakcí (Salazar-Jaramillo et al., 2014). Identifikovali jsme několik nových genů, které vznikly přibližně v době získání lamelocytů a jsou diferenciálně exprimovány během imunitní odpovědi proti parazitoidům, včetně receptorových molekul a proteáz serinového typu (Salazar-Jaramillo et al., 2014). Předpokládáme, že zejména endopeptidázy serinového typu mohou hrát klíčovou roli v tomto rozšíření sítě genových interakcí. Značné množství těchto molekul vzniklo v době akvizice lamelocytů, jsou exprimovány ve správný okamžik imunitní odpovědi a vykazují silné známky pozitivní selekce (Wertheim et al., 2005; Salazar-Jaramillo et al., 2014).
I v rámci jednoho druhu, D. melanogaster, vykazují imunitní odpovědi velkou genetickou variabilitu. Terénní populace sesbírané napříč Evropou vykazují značné rozdíly ve schopnosti úspěšně opouzdřit vajíčka parazitoidů (Kraaijeveld a van Alphen, 1995; Kraaijeveld a Godfray, 1999; Gerritsma et al., 2013). Náklady a přínosy silné imunitní obrany se zřejmě geograficky liší, což vede k modulaci a diferenciaci koadaptovaných genetických sítí. To se projevilo i v hemocytární odpovědi po napadení parazitoidy. Polní linie se značně lišily v absolutním a relativním počtu různých hemocytů, které produkovaly v reakci na útok parazitoidů, a to i mezi liniemi, které byly velmi úspěšné v enkapsulaci (Gerritsma et al., 2013). To znovu zdůrazňuje, že genetické pozadí populace a kombinované lokální selekční tlaky vedou k alternativním evolučním reakcím. Porovnání genomů rezistentních a náchylných jedinců z několika populací může odhalit adaptivní variabilitu v genetické architektuře tohoto znaku.
Pro zmapování změn v genomu během evoluce zvýšené rezistence jsme provedli experimentální evoluci pro rezistenci vůči parazitoidům. V laboratoři jsme vystavili velkou outbrední populaci parazitoidům. Pouze larvy, kterým se podařilo přežít útok parazitoidů, mohly přispět do další generace. Tímto přístupem jsme po pouhých pěti generacích selekce zvýšili úroveň rezistence z 20 na ∼50 % larev, které přežily útok parazitoidů. Když jsme měřili změny v expresi genů v selektovaných populacích ve srovnání s expresí genů v kontrolních liniích ještě před útokem parazitoidů, zjistili jsme několik stovek genů, které byly mírně odlišně regulovány (Wertheim et al., 2011). Změny se týkaly především genů, které nebyly diferenciálně exprimovány během imunitní odpovědi, což naznačuje, že evoluční změny neaktivovaly imunitní odpověď v očekávání útoku parazitoidů, ale modulovaly kanonickou vývojovou dráhu, což (také) vedlo ke zvýšení jejích obranných schopností. Tento experiment jsme zopakovali a poté jsme sekvenovali genomy selektované a kontrolní populace. V genomech linií, u nichž se vyvinula zvýšená odolnost, jsme našli známky selekce na několika úzce vymezených oblastech genomu (Jalvingh et al., 2014). Některé z těchto oblastí se také překrývaly s oblastmi, které vykazovaly změněnou expresi po selekci na zvýšenou odolnost (Wertheim et al., 2011; Jalvingh et al., 2014). Rychlý a silný selekční zásah u tak komplexního znaku, jakým je imunita, tak může ovlivnit více, ale vysoce lokalizovaných genomických oblastí.
Budoucí výzvy
Jak sladíme dlouhodobé evoluční změny, jako je získávání nových genů v sítích genových interakcí, a krátkodobé evoluční změny, jako jsou sekvenční varianty, které mohou být v populaci zameteny? Klíčem k tomu je (i) rekonstruovat síť genových interakcí, která je základem komplexních znaků, a (ii) charakterizovat roli genetické variability v těchto sítích. Genetické sítě se mohou rozšiřovat o nové geny např. prostřednictvím duplikací, mohou se propojovat s jinými sítěmi nebo moduly a malé sekvenční variace mohou modulovat aktivitu a topologii sítí. Pokud dokážeme rozložit genetické sítě a posoudit roli genetických variant v kontextu sítě, umožní nám to nakonec určit, jak se genetická variabilita promítá do fenotypové variability. To také zlepší naše chápání molekulárního základu složitých lidských onemocnění a evoluce vrozené a získané imunity (Cooper a Alder, 2006; Manolio et al., 2009; Star et al., 2011; Mackay a Moore, 2014; Sironi et al., 2015).
Systémově biologické přístupy budou neocenitelné pro odhalení složitých sítí genových interakcí. Tam se vyvíjejí matematické modely, které popisují molekulární mechanismy, jež jsou základem daného znaku, a předpovídají dynamiku skupin interagujících složek sítě. Modely jsou založeny na údajích molekulární genetiky a genomiky. V současné době se systémová biologie většinou aplikuje na specifické znaky u jednobuněčných organismů, a to je považováno za hranici toho, čeho lze dosáhnout (Papp et al., 2011). Je však pravděpodobné, že tento model nemusí být reprezentativní pro evoluci u pohlavně se rozmnožujících mnohobuněčných organismů. Spíše než čekat, až zjednodušené modely budou přesně odrážet malé dílčí sítě, musíme vyvinout a zdokonalit naše metody, abychom využili a kvantifikovali emergentní vlastnosti z obrovského množství genomických dat. Můžeme odvozovat sítě genových interakcí z korelací protein-protein nebo transkriptů nebo z matic koexprese (Shannon et al., 2003; Langfelder a Horvath, 2008) a spojovat je s analýzami přirozených variant (Nuzhdin et al., 2012). Tyto metody a alternativní přístupy bychom měli dále rozvíjet, abychom plně využili naše měření na genomických datech a převedli tato kvantitativní měření do síťových analýz. Ačkoli genomická data sama o sobě neposkytnou úplnou odpověď na otázku, co určuje adaptivní schopnost života, umožňují nám kvantifikovat a pozorovat, co se děje na molekulární úrovni během evoluce. Když to zkombinujeme a propojíme s heterogenitou prostředí jako hnací silou adaptací, možná budeme schopni odhalit složité molekulární mechanismy adaptace a evoluce.
Prohlášení o střetu zájmů
Autor prohlašuje, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Poděkování
Děkuji Kirsten Jalvingh, Lauře Salazar-Jaramillo a Sylvii Gerritsma za cenné diskuse. BW byl podpořen finančními prostředky Nizozemské organizace pro vědecký výzkum (NWO; grant 864.08.008).
Aggarwal, K., and Silverman, N. (2008). Pozitivní a negativní regulace imunitní odpovědi drozofily. BMB Rep. 41, 267-277. doi: 10.5483/BMBRep.2008.41.4.267
PubMed Abstract | CrossRef Full Text | Google Scholar
Ayroles, J. F., Carbone, M. A., Stone, E. A., Jordan, K. W., Lyman, R. F., Magwire, M. M. a další (2009). Systémová genetika komplexních znaků u Drosophila melanogaster. Nat. Genet. 41, 299-307. doi: 10.1038/ng.332
PubMed Abstract | CrossRef Full Text | Google Scholar
Brennan, C. A., and Anderson, K. V. (2004). Drosophila: genetika rozpoznávání a reakce vrozené imunity. Annu. Rev. Immunol. 22, 457-483. doi: 10.1146/annurev.immunol.22.012703.104626
PubMed Abstract | CrossRef Full Text | Google Scholar
Buchmann, K. (2014). Evoluce vrozené imunity: stopy od bezobratlých přes ryby k savcům. Front. Immunol. 5:459. doi: 10.3389/fimmu.2014.00459
PubMed Abstract | CrossRef Full Text | Google Scholar
Carpenter, S., Ricci, E. P., Mercier, B. C., Moore, M. J., and Fitzgerald, K. A. (2014). Posttranskripční regulace genové exprese ve vrozené imunitě. Nat. Rev. Immunol. 14, 361-376. doi: 10.1038/nri3682
PubMed Abstract | CrossRef Full Text | Google Scholar
Cooper, M. D., and Alder, M. N. (2006). Evoluce adaptivních imunitních systémů. Cell 124, 815-822. doi: 10.1016/j.cell.2006.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Dobzhansky, T. (1964). Biologie, molekulární a organismální. Am. Zool. 4, 443-452.
PubMed Abstract | Google Scholar
Drosophila 12 Genomes Consortium, Clark, A. G., Eisen, M. B., Smith, D. R., Bergman, C. M., Oliver, B., et al. (2007). Evoluce genů a genomů na fylogenezi drozofily. Nature 450, 203-218. doi: 10.1038/nature06341
PubMed Abstract | CrossRef Full Text | Google Scholar
Edwards, A. C., Ayroles, J. F., Stone, E. A., Carbone, M. A., Lyman, R. F., and Mackay, T. F. C. (2009). Transkripční síť spojená s přirozenou variabilitou v agresivním chování drozofil. Genome Biol. 10, R76. doi: 10.1186/gb-2009-10-7-r76
PubMed Abstract | CrossRef Full Text | Google Scholar
Eslin, P., and Doury, G. (2006). Moucha Drosophila subobscura: přirozený případ nedostatku vrozené imunity. Dev. Comp. Immunol. 30, 977-983. doi: 10.1016/j.dci.2006.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, C. J., Hartenstein, V., and Banerjee, U. (2003). Silnější než krev: konzervované mechanismy v krvetvorbě drozofil a obratlovců. Dev. Cell 5, 673-690. doi: 10.1016/S1534-5807(03)00335-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Fay, J. C., McCullough, H. L., Sniegowski, P. D., and Eisen, M. B. (2004). Populační genetická variabilita v genové expresi je spojena s fenotypovou variabilitou u Saccharomyces cerevisiae. Genome Biol. 5, R26. doi: 10.1186/gb-2004-5-4-r26
PubMed Abstract | CrossRef Full Text | Google Scholar
Fleury, F., Gibert, P., Ris, N., and Allemand, R. (2009). Ecology and life history evolution of frugivorous Drosophila parasitoids [Ekologie a evoluce životní historie frugivorních parazitoidů rodu Drosophila]. Adv. Parasitol. 70, 3-44. doi: 10.1016/S0065-308X(09)70001-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Gasch, A. P., Spellman, P. T., Kao, C. M., Carmel-Harel, O., Eisen, M. B., Storz, G., et al. (2000). Genomové expresní programy v reakci kvasinkových buněk na změny prostředí. Mol. Biol. Cell 11, 4241-4257. doi: 10.1091/mbc.11.12.4241
PubMed Abstract | CrossRef Full Text | Google Scholar
Gerritsma, S., de Haan, A., van de Zande, L., and Wertheim, B. (2013). Přirozená variabilita diferencovaných hemocytů souvisí s odolností vůči parazitoidům u Drosophila melanogaster. J. Insect Physiol. 59, 148-158. doi: 10.1016/j.jinsphys.2012.09.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Havard, S., Doury, G., Ravallec, M., Brehélin, M., Prevost, G., and Eslin, P. (2012). Strukturní a funkční charakterizace pseudopodocytu, košaté imunitní buňky produkované dvěma druhy Drosophila ze skupiny obscura. Dev. Comp. Immunol. 36, 323-331. doi: 10.1016/j.dci.2011.05.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Hunt, P., Martinelli, A., Modrzynska, K., Borges, S., Creasey, A., Rodrigues, L., et al. (2010). Experimentální evoluce, genetická analýza a resekvenování genomu odhalují mutaci propůjčující rezistenci k artemisininu v izogenní linii parazitů malárie. BMC Genomics 11:499. doi: 10.1186/1471-2164-11-499
PubMed Abstract | CrossRef Full Text | Google Scholar
Ivanov, P., and Anderson, P. (2013). Posttranskripční regulační sítě v imunitě. Immunol. Rev. 253, 253-272. doi: 10.1111/imr.12051
PubMed Abstract | CrossRef Full Text | Google Scholar
Jalvingh, K. M., Chang, P. L., Nuzhdin, S. V., and Wertheim, B. (2014). Genomické změny v podmínkách rychlé evoluce: selekce na odolnost vůči parazitoidům. Proc. Biol. Sci. 281, 20132303. doi: 10.1098/rspb.2013.2303
PubMed Abstract | CrossRef Full Text | Google Scholar
Jones, F. C., Grabherr, M. G., Chan, Y. F., Russell, P., Mauceli, E., Johnson, J., et al. (2012). The genomic basis of adaptive evolution in threespine sticklebacks [Genomický základ adaptivní evoluce u nártouna trojitého]. Nature 484, 55-61. doi: 10.1038/nature10944
PubMed Abstract | CrossRef Full Text | Google Scholar
Knight, C. G., Zitzmann, N., Prabhakar, S., Antrobus, R., Dwek, R., Hebestreit, H., et al. (2006). Odhalování adaptivní evoluce: jak jediná bodová mutace ovlivňuje proteinovou koegulační síť. Nat. Genet. 38, 1015. doi: 10.1038/ng1867
PubMed Abstract | CrossRef Full Text | Google Scholar
Kraaijeveld, A. R., and Godfray, H. C. J. (1999). Geografické vzorce evoluce rezistence a virulence u Drosophila a jeho parazitoidů. Am. Nat. 153, S61-S74. doi: 10.1086/303212
CrossRef Full Text | Google Scholar
Kraaijeveld, A. R., Ferrari, J., and Godfray, H. C. J. (2002). Costs of resistance in insect-parasite and insect-parasitoid interactions (Náklady rezistence v interakcích mezi hmyzem a parazity a hmyzem a parazitoidy). Parasitology 125(Suppl.), S71-S82. doi: 10.1017/S0031182002001750
PubMed Abstract | CrossRef Full Text | Google Scholar
Kraaijeveld, A. R., and van Alphen, J. J. M. (1995). Geografická variabilita ve schopnosti enkapsulace larev Drosophila melanogaster a důkazy pro složky specifické pro parazitoidy. Evol. Ecol. 9, 10-17. doi: 10.1007/BF01237692
CrossRef Full Text | Google Scholar
Langfelder, P., and Horvath, S. (2008). WGCNA: balíček R pro váženou korelační síťovou analýzu. BMC Bioinformatics 9:559. doi: 10.1186/1471-2105-9-559
PubMed Abstract | CrossRef Full Text | Google Scholar
Lavine, M. D., and Strand, M. R. (2002). Hmyzí hemocyty a jejich úloha v imunitě. Insect Biochem. Mol. Biol. 32, 1295-1309. doi: 10.1016/S0965-1748(02)00092-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Lazzaro, B. P., and Little, T. J. (2009). Imunita v proměnlivém světě. Philos. Trans. R. Soc. Lond. B Biol. Sci. 364, 15-26. doi: 10.1098/rstb.2008.0141
PubMed Abstract | CrossRef Full Text | Google Scholar
Lazzaro, B. P., and Schneider, D. S. (2014). Genetika imunity. G3 (Bethesda) 4, 943-945. doi: 10.1534/g3.114.011684
PubMed Abstract | CrossRef Full Text | Google Scholar
Lehner, B. (2013). Od genotypu k fenotypu: poučení z modelových organismů pro lidskou genetiku. Nat. Rev. Genet. 14, 168-178. doi: 10.1038/nrg3404
PubMed Abstract | CrossRef Full Text | Google Scholar
Lemaitre, B., and Hoffmann, J. (2007). Obrana hostitele u Drosophila melanogaster. Annu. Rev. Immunol. 25, 697-743. doi: 10.1146/annurev.immunol.25.022106.141615
PubMed Abstract | CrossRef Full Text | Google Scholar
Liew, F. Y., Xu, D., Brint, E. K., and O’Neill, L. A. J. (2005). Negativní regulace imunitních odpovědí zprostředkovaných Toll-like receptory. Nat. Rev. Immunol. 5, 446-458. doi: 10.1038/nri1630
PubMed Abstract | CrossRef Full Text | Google Scholar
Linnen, C. R., Poh, Y.-P., Peterson, B. K., Barrett, R. D. H., Larson, J. G., Jensen, J. D., et al. (2013). Adaptivní evoluce více znaků prostřednictvím více mutací v jednom genu. Science 339, 1312-1316. doi: 10.1126/science.1233213
PubMed Abstract | CrossRef Full Text | Google Scholar
Mackay, T. F., and Moore, J. H. (2014). Proč je epistáze důležitá pro řešení komplexní genetiky lidských onemocnění. Genome Med. 6, 42. doi: 10.1186/gm561
PubMed Abstract | CrossRef Full Text | Google Scholar
Manolio, T. A., Collins, F. S., Cox, N. J., Goldstein, D. B., Hindorff, L. A., Hunter, D. J. a další (2009). Hledání chybějící dědičnosti komplexních onemocnění. Nature 461, 747-753. doi: 10.1038/nature08494
PubMed Abstract | CrossRef Full Text | Google Scholar
Márkus, R., Lerner, Z., Honti, V., Csordás, G., Zsámboki, J., Cinege, G., et al. (2015). Multinukleární obrovské hemocyty jsou efektorové buňky v buněčně zprostředkované imunitní odpovědi drozofily. J. Innate Immun. doi: 10.1159/000369618 .
PubMed Abstract | CrossRef Full Text | Google Scholar
Moore, J. H., and Williams, S. M. (eds). (2015). Epistasis. New York, NY: Springer. doi: 10.1007/978-1-4939-2155-3
CrossRef Full Text | Google Scholar
Nagy, A., Perrimon, N., Sandmeyer, S., and Plasterk, R. (2003). Přizpůsobení genomu: síla genetických přístupů. Nat. Genet. 33(Suppl.), 276-284. doi: 10.1038/ng1115
PubMed Abstract | CrossRef Full Text | Google Scholar
Nowick, K., Gernat, T., Almaas, E., and Stubbs, L. (2009). Rozdíly ve vzorcích exprese lidských a šimpanzích genů definují vyvíjející se síť transkripčních faktorů v mozku. Proc. Natl. Acad. Sci. U.S.A. 106, 22358-22363. doi: 10.1073/pnas.0911376106
PubMed Abstract | CrossRef Full Text | Google Scholar
Nuzhdin, S. V., Friesen, M. L., and McIntyre, L. M. (2012). Genotype-phenotype mapping in a post-GWAS world (Mapování genotypu a fenotypu ve světě po ukončení GWAS). Trends Genet. 28, 421-426. doi: 10.1016/j.tig.2012.06.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Obbard, D. J., Welch, J. J., Kim, K.-W., and Jiggins, F. M. (2009). Kvantifikace adaptivní evoluce v imunitním systému drozofily. PLoS Genet. 5:e1000698. doi: 10.1371/journal.pgen.1000698
PubMed Abstract | CrossRef Full Text | Google Scholar
Papp, B., Notebaart, R. A., and Pál, C. (2011). Přístupy systémové biologie k předpovídání genomové evoluce. Nat. Rev. Genet. 12, 591-602. doi: 10.1038/nrg3033
PubMed Abstract | CrossRef Full Text | Google Scholar
Pedra, J. H. F., McIntyre, L. M., Scharf, M. E., and Pittendrigh, B. R. (2004). Celogenomový transkripční profil terénně a laboratorně selektovaných drozofil odolných vůči dichlordifenyltrichlorethanu (DDT). Proc. Natl. Acad. Sci. U.S.A. 101, 7034-7039. doi: 10.1073/pnas.0400580101
PubMed Abstract | CrossRef Full Text | Google Scholar
Phillips, P. C. (2008). Epistáze – zásadní role genových interakcí ve struktuře a evoluci genetických systémů. Nat. Rev. Genet. 9, 855-867. doi: 10.1038/nrg2452
PubMed Abstract | CrossRef Full Text | Google Scholar
Rolff, J. a Siva-Jothy, M. T. (2003). Ekologická imunologie bezobratlých. Science 301, 472-475. doi: 10.1126/science.1080623
PubMed Abstract | CrossRef Full Text | Google Scholar
Sackton, T. B., Lazzaro, B. P., Schlenke, T. A., Evans, J. D., Hultmark, D., and Clark, A. G. (2007). Dynamická evoluce vrozeného imunitního systému u drozofily. Nat. Genet. 39, 1461-1468. doi: 10.1038/ng.2007.60
PubMed Abstract | CrossRef Full Text | Google Scholar
Salazar-Jaramillo, L., Paspati, A., van de Zande, L., Vermeulen, C. J., Schwander, T., and Wertheim, B. (2014). Evoluce buněčné imunitní odpovědi u drozofily: fenotypová a genomická srovnávací analýza. Genome Biol. Evol. 6, 273-289. doi: 10.1093/gbe/evu012
PubMed Abstract | CrossRef Full Text | Google Scholar
Schadt, E. E. (2009). Molekulární sítě jako senzory a příčiny běžných lidských onemocnění. Nature 461, 218-223. doi: 10.1038/nature08454
PubMed Abstract | CrossRef Full Text | Google Scholar
Schlenke, T. A., Morales, J., Govind, S., and Clark, A. G. (2007). Kontrastní infekční strategie u generalistických a specializovaných parazitoidů vosičky Drosophila melanogaster. PLoS Pathog. 3:e158. doi: 10.1371/journal.ppat.0030158
PubMed Abstract | CrossRef Full Text | Google Scholar
Schmid-Hempel, P. (2003). Variabilita imunitní obrany jako otázka evoluční ekologie. Proc. R. Soc. B Biol. Sci. 270, 357-366. doi: 10.1098/rspb.2002.2265
PubMed Abstract | CrossRef Full Text | Google Scholar
Schmid-Hempel, P. (2005). Evoluční ekologie imunitní obrany hmyzu. Annu. Rev. Entomol. 50, 529-551. doi: 10.1146/annurev.ento.50.071803.130420
PubMed Abstract | CrossRef Full Text | Google Scholar
Shannon, P., Markiel, A., Ozier, O., Baliga, N. S., Wang, J. T., Ramage, D., et al. (2003). Cytoscape: softwarové prostředí pro integrované modely biomolekulárních interakčních sítí. Genome Res. 13, 2498-2504. doi: 10.1101/gr.1239303
PubMed Abstract | CrossRef Full Text | Google Scholar
Silverman, N., and Maniatis, T. (2001). Signální dráhy NF-κB ve vrozené imunitě savců a hmyzu. Genes Dev. 15, 2321-2342. doi: 10.1101/gad.909001
PubMed Abstract | CrossRef Full Text | Google Scholar
Sironi, M., Cagliani, R., Forni, D. a Clerici, M. (2015). Evoluční vhled do interakcí mezi hostitelem a patogenem na základě sekvenčních dat savců. Nat. Rev. Genet. 16, 224-236. doi: 10.1038/nrg3905
PubMed Abstract | CrossRef Full Text | Google Scholar
Stapley, J., Reger, J., Feulner, P. G. D., Smadja, C., Galindo, J., Ekblom, R., et al. (2010). Adaptační genomika: nová generace. Trends Ecol. Evol. 25, 705-712. doi: 10.1016/j.tree.2010.09.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Star, B., Nederbragt, A. J., Jentoft, S., Grimholt, U., Malmstrøm, M., Gregers, T. F., et al. (2011). Sekvence genomu tresky obecné odhaluje jedinečný imunitní systém. Nature 477, 207-210. doi: 10.1038/nature10342
PubMed Abstract | CrossRef Full Text | Google Scholar
Stearns, F. W. (2010). Sto let pleiotropie: retrospektiva. Genetics 186, 767-773. doi: 10.1534/genetics.110.122549
PubMed Abstract | CrossRef Full Text | Google Scholar
Storz, J. F., and Wheat, C. W. (2010). Integrace evolučních a funkčních přístupů k odvození adaptace na specifických lokusech. Evolution 64, 2489-2509. doi: 10.1111/j.1558-5646.2010.01044.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tenaillon, O., Rodríguez-Verdugo, A., Gaut, R. L., McDonald, P., Bennett, A. F., Long, A. D., et al. (2012). Molekulární rozmanitost adaptivní konvergence. Science 335, 457-461. doi: 10.1126/science.1212986
PubMed Abstract | CrossRef Full Text | Google Scholar
Turner, T. L., Stewart, A. D., Fields, A. T., Rice, W. R., and Tarone, A. M. (2011). Populační resekvenování experimentálně vyvinutých populací odhaluje genetický základ variability velikosti těla u Drosophila melanogaster. PLoS Genet. 7:e1001336. doi: 10.1371/journal.pgen.1001336
PubMed Abstract | CrossRef Full Text | Google Scholar
Wagner, G. P., and Altenberg, L. (1996). Komplexní adaptace a evoluce evoluční schopnosti. Evolution 50, 967-976. doi: 10.2307/2410639
CrossRef Full Text | Google Scholar
Wertheim, B., Kraaijeveld, A. R., Hopkins, M. G., Walther Boer, M., and Godfray, H. C. (2011). Funkční genomika evoluce zvýšené odolnosti vůči parazitismu u drozofily. Mol. Ecol. 20, 932-949. doi: 10.1111/j.1365-294X.2010.04911.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Wertheim, B., Kraaijeveld, A. R., Schuster, E., Blanc, E., Hopkins, M., Pletcher, S. D., et al. (2005). Genome-wide gene expression in response to parasitoid attack in Drosophila (Exprese genů v reakci na útok parazitoidů u drozofily). Genome Biol. 11, R94. doi: 10.1186/gb-2005-6-11-r94
PubMed Abstract | CrossRef Full Text | Google Scholar
Zak, D. E., Tam, V. C., and Aderem, A. (2014). Analýza vrozené imunity na systémové úrovni. Annu. Rev. Immunol. 32, 547-577. doi: 10.1146/annurev-immunol-032713-120254
PubMed Abstract | CrossRef Full Text | Google Scholar
.