Miért van szükségünk rekombináns fehérjékre?
A fehérjék a biológiai rendszerek munkagépei, amelyek a legtöbb biológiai folyamatot elősegítik a sejtben, beleértve a génexpressziót, a sejtnövekedést, a sejtburjánzást, a tápanyagfelvételt, a sejtek közötti kommunikációt és az apoptózist. A fehérjeszintézis alaprajzát a DNS tárolja, amely sablonként szolgál az erősen szabályozott transzkripciós folyamatok számára a hírvivő RNS (mRNS) előállításához. Az mRNS által kódolt üzenetet ezután a fehérjét alkotó aminosavak meghatározott szekvenciáira fordítják le. A fehérjék szintézise minden élőlényben hasonló kétlépcsős folyamat során történik – a DNS-t először RNS-vé írják át, majd az RNS-t fehérjévé fordítják.
Mi a rekombináns fehérjék?
A rekombináns fehérjék olyan rekombináns DNS által kódolt fehérjék, amelyeket olyan expressziós vektorba klónoztak, amely támogatja a gén kifejeződését és a hírvivő RNS transzlációját. A gén rekombináns DNS-technológiával történő módosítása mutáns fehérje kifejeződéséhez vezethet. A rekombináns fehérje a natív fehérje manipulált formája, amelyet különböző módon állítanak elő a fehérjék termelésének növelése, a génszekvenciák módosítása és hasznos kereskedelmi termékek előállítása érdekében.
Hogyan készülnek a rekombináns fehérjék?
A rekombináns fehérje előállítása genetikai szinten kezdődik, ahol először izolálják és egy expressziós plazmidvektorba klónozzák a kívánt fehérje kódoló szekvenciáját. A legtöbb terápiás célú rekombináns fehérje emberből származik, de mikroorganizmusokban, például baktériumokban, élesztőben vagy tenyésztett állati sejtekben fejeződik ki. Az emberi gének nagyon összetettek, gyakran tartalmaznak intronoknak nevezett, nem kódoló DNS-szekvenciákat. Ezért a gén intronmentes változatát gyakran úgy állítják elő, hogy az mRNS-t cDNS-vé alakítják át. Mivel a cDNS-ből hiányoznak a szabályozó régiók, az expressziós vektorok promóter, riboszóma-kötőhely és terminátor szekvenciákat biztosítanak. A kutatási célú rekombináns fehérje előállítását elsősorban a folyamat költséghatékonysága, egyszerűsége és gyorsasága vezérli a termék megfelelő hozamával együtt. A baktériumokban együttesen kifejezett fehérjék nem rendelkeznek poszttranszlációs módosításokkal, pl. foszforilációval vagy glikozilációval; ehhez eukarióta expressziós rendszerekre van szükség.
Néhány rekombináns fehérje olyan fehérjemódosításokat igényel, mint például a glikoziláció, amelyek csak eukarióta sejtekben állnak rendelkezésre. Élesztő-, rovarsejtek és emlős sejttenyésztési rendszerek kínálnak ilyen poszttranszlációs módosításokat. Az elmúlt évtizedben állítólag hatékony tranziens transzfekciós protokollokat fejlesztettek ki. A fehérjék tranziens előállítására HEK293-ból származó sejtvonalakat alkalmaznak. Jelenleg a legtöbb rekombináns terápiás fehérjét emlőssejtekben állítják elő, mivel az emlőssejtek képesek a természetben előforduló fehérjékhez hasonló minőségű fehérjék előállítására. Ezenkívül számos engedélyezett rekombináns terápiás fehérjét E.coli sejtben állítanak elő a jól jellemzett genetika, a gyors növekedés és a nagy hozamú termelés miatt.
Biogyógyászati kutatás az egészség és a betegségek megértésére
A rekombináns fehérjék hasznos eszközök a fehérje-fehérje kölcsönhatások megértésében. A fehérje kölcsönhatások alapvetően stabilnak vagy átmenetinek jellemezhetők, és fontos szerepet játszanak a sejtfolyamatokban. A közelmúltban váltak népszerűvé a fehérje-fehérje kölcsönhatások vizsgálatára szolgáló RP-mikrotáblák. Ennél a megközelítésnél a kutatók egy tárgylemezt számos immobilizált fehérjével vetnek be, amelyeket aztán különböző molekulákkal kezelnek, hogy megvizsgálják, hogyan lép kölcsönhatásba egymással a két szer. Ezzel a rendszerrel a tudósok tanulmányozták a fehérjék kölcsönhatásait más fehérjékkel vagy peptidekkel, enzimekkel, kis molekulákkal, lipidekkel és nukleinsavakkal. Ez sokkal nagyobb áteresztőképességet tesz lehetővé a fehérje-fehérje kölcsönhatások tanulmányozásakor.
A rekombináns fehérjék teljesítménye számos laboratóriumi technikában, például az ELISA, a western blot és az immunhisztokémia (IHC) során bizonyított. A rekombináns fehérjéket enzimatikus próbák kifejlesztésére használják. Egy megfelelő antitestpárral együtt alkalmazva a rekombináns fehérjék standardként használhatók ELISA-ban, valamint pozitív kontrollként western blotban és IHC-ban. A rekombináns fehérjék értékes eszközként szolgálnak a stresszre adott sejtválasz és a betegségekre adott válaszok vizsgálatához. A betegség állatmodelljeinek beadott rekombináns fehérjék és peptidek segítik a kutatókat az új potenciális terápiás jelöltek azonosításában.
Rekombináns fehérjék bioterápiás célokra
A legtöbb emberi betegség szisztémásan vagy részben specifikus fehérjék diszfunkciójával függ össze. A terápiás fehérjék számos betegség, például a cukorbetegség, a rák, a fertőző betegségek, a hemofília és a vérszegénység fontos terápiáját biztosítják. A gyakori terápiás fehérjék közé tartoznak az antitestek, az Fc fúziós fehérjék, a hormonok, az interleukinok, az enzimek és az antikoagulánsok. A géntechnológiával előállított emberi fehérjék kulcsszerepet játszanak a terápiás gyógyszerek piacán. Az FDA által jóváhagyott számos RP vakcina egyike a Hepatitis B vakcina, amely a Hepatitis B vírus valamennyi ismert altípusa által okozott fertőzés megelőzésére szolgál.
Az első gyógyításra használt rekombináns fehérje a rekombináns humán inzulin volt 1982-ben, és a RP-iparág azóta gyorsan növekedett. Napjainkig több mint 130 RP-t hagyott jóvá klinikai felhasználásra az amerikai FDA. Ugyanakkor világszerte több mint 170 RP-t állítanak elő és használnak a gyógyászatban. A rekombináns humán inzulin nagyon korai példája volt a biotechnológia gyógyszerfejlesztésben való alkalmazásának. A rekombináns fehérjék hatékony gyógyszerek, amelyek biztonságban vannak a célzott mellékhatásoktól, és rövidebb ideig tart a kifejlesztésük, mint a kismolekuláké. Ma már az összes nagy gyógyszergyártó cég RP-t fejleszt ki gyógyszerként, és így ez egy több milliárd dolláros iparág.
A klinikumban használt rekombináns fehérjék közé tartoznak a rekombináns hormonok, interferonok, interleukinok, növekedési faktorok, tumor nekrózis faktorok, véralvadási faktorok, trombolytikus gyógyszerek és enzimek olyan súlyos betegségek kezelésére, mint a cukorbetegség, törpeség, szívinfarktus, pangásos szívelégtelenség, agyvérzés, szklerózis multiplex, neutropenia, trombocitopénia, vérszegénység, hepatitis, reumatoid arthritis, asztma, Crohn-betegség és rákos megbetegedések terápiái. Az Enzo számos referált idézettel alátámasztva rekombináns és natív fehérjék széles választékát kínálja a legkülönbözőbb kutatási területek számára. Fehérjéinket specifikus funkcionális teszteken validáljuk, és a legszigorúbb minőségi követelmények szerint állítjuk elő.
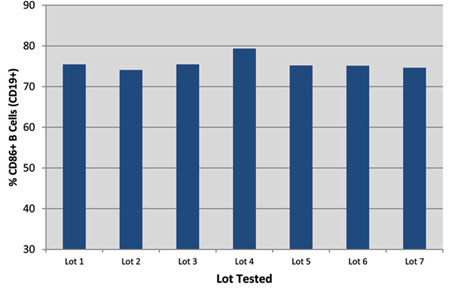
1. ábra: 1. ábra. A megbízható gyártás következetes eredményeket eredményez. A 7 egymást követő gyártási tételből származó MEGACD40L fehérjét 1000 ng/ml-es B-sejt-aktivációs teszttel vizsgálták.
A rekombináns fehérjéket az élelmiszertermelésben, a mezőgazdaságban és a biotechnológiában használják. A tenyésztési iparban például enzimek adhatók az állati takarmányhoz, hogy növeljék a takarmány-összetevők tápértékét, csökkentsék a takarmány- és hulladékkezelési költségeket, támogassák az állatok bélrendszerének egészségét, fokozzák az állatok teljesítményét és javítsák a környezetet. Emellett a tejsavbaktériumokat (LAB) már régóta használják erjesztett élelmiszerek előállítására. A közelmúltban a LAB-okat rekombináns fehérjék kifejezésére tervezték, amelyeknek számos alkalmazási területe lesz, például az emberi/állati emésztés és táplálkozás javítása.
A biotechnológia területén bekövetkezett fejlődés megnövelte és megkönnyítette a rekombináns fehérjék előállítását különböző alkalmazásokhoz. A RP jelentősége gyorsan nőtt az élettudományi alapkutatás, a diagnosztikai reagensek és a terápiás gyógyszerek tekintetében. A biotechnológiában betöltött szerepük pótolhatatlan. További előrelépést várunk a különböző betegségek rekombináns fehérjékkel történő kezelésében is. Az Enzo széles körben idézett és alaposan validált natív és rekombináns fehérjék katalógusa segíteni fogja e kutatások felgyorsítását. Az aktív enzimek tervezésében és gyártásában, valamint a gyógyszerkutatási készletekben szerzett több évtizedes tapasztalatunk eszközöket kínál a specifikus enzimek inhibitorainak szűréséhez és a potenciális terápiás célpont azonosításához. Kérjük, további segítségért forduljon műszaki támogatási csapatunkhoz.