Diagnostika a léčba Sjögrenova syndromu
Podklady: Sjögrenův syndrom je jedním z nejčastějších zánětlivých revmatologických onemocnění, jehož prevalence v Německu dosahuje nejméně 0,4 %
Metody: Tento přehled vychází z relevantních článků získaných selektivním vyhledáváním v databázi PubMed. Zvláštní pozornost je věnována aktualizovaným klasifikačním kritériím a současným doporučením pro léčbu.
Výsledky: Sjögrenův syndrom má širokou škálu projevů, od lokálního postižení exokrinních žláz s keratoconjunctivitis sicca a xerostomií (hlavní příznaky onemocnění) až po systémové, extraglandulární postižení více orgánů. Únava také výrazně zhoršuje kvalitu života pacientů. Sérologické vyšetření odhalí antinukleární autoprotilátky (anti-Ro/SSA a anti-La/SSB) a také revmatoidní faktory. Histologickým znakem onemocnění je fokální lymfocytární infiltrace v jinak normálně vypadajících žlázových acinech. Onemocnění také výrazně zvyšuje riziko vzniku nehodgkinského lymfomu B-buněčné řady, který vzniká přibližně u 5 % pacientů. Primární Sjögrenův syndrom (pSS) se liší od sekundární formy (sSS), která se objevuje v rámci jiného autoimunitního onemocnění, zejména systémového lupus erythematodes (15-36 %), revmatoidní artritidy (20-32 %) a omezené nebo progresivní systémové sklerózy (11-24 %). Modifikující léčba je vyhrazena pro pacienty se systémovým postižením; důkazy o její účinnosti jsou omezené. Vzhledem ke komplexnosti tohoto onemocnění mohou některé jeho klinické projevy vyžadovat mezioborovou léčbu.
Závěr: V interdisciplinární péči o pacienty se Sjögrenovou chorobou je třeba zvážit především opatření ke zlepšení kvality života, farmakologickou a nefarmakologickou léčbu k udržení aktivity onemocnění pod kontrolou a řízení rizika vzniku lymfomu. Budoucí terapeutické přístupy musí zohlednit heterogenitu onemocnění.
![]()
![]()
Sjögrenův syndrom je chronické zánětlivé autoimunitní onemocnění neznámého původu, které napadá zejména slzné a slinné žlázy. Příznaky sicca jsou charakteristickými znaky onemocnění, které se může projevovat i různými orgánovými projevy. Vzhledem k široké škále příznaků a symptomů mohou pacienti se Sjögrenovým syndromem při první konzultaci navštívit různorodé zdravotnické pracovníky, včetně rodinných lékařů, oftalmologů, ORL specialistů a zubařů. Je tedy nezbytné, aby lékaři různých specializací byli informováni o aktuálních aspektech klinických projevů onemocnění, revidovaných klasifikačních kritériích a současných možnostech léčby.
Primární Sjögrenův syndrom (pSS) se odlišuje od sekundárního Sjögrenova syndromu (sSS), který se vyskytuje jako součást jiných autoimunitních onemocnění. SSS koexistuje zejména se systémovým lupus erythematodes (15-36 %), revmatoidní artritidou (20-32 %) a také s ohraničenou a progresivní systémovou sklerózou (11-24 %), méně často s roztroušenou sklerózou a autoimunitní hepatitidou a tyreoiditidou (1). Termín „sekundární“ zde nepopisuje chronologickou posloupnost manifestace onemocnění: Základní onemocnění se může zpočátku projevovat příznaky sicca a projevit se až později v průběhu onemocnění. Stanovení diagnózy je u pacientů s překrývajícími se chorobnými jednotkami často náročné. Vzhledem k odlišnému průběhu onemocnění (včetně prognózy) je důležité rozlišovat mezi primární a sekundární formou Sjögrenova syndromu.
Epidemiologie
Heterogenita dostupných údajů o prevalenci a incidenci Sjögrenova syndromu se vysvětluje rozdíly v designu studií a klasifikačních kritériích. Celosvětová prevalence vypočtená pro vzácnější pSS je 61 na 100 000 obyvatel, přičemž nejvyšší prevalence se vyskytuje v Evropě (2). U žen se Sjögrenův syndrom vyskytuje výrazně častěji než u mužů; rozdíl mezi pohlavími se pohybuje v rozmezí 9:1 až 19:1. Průměrný věk v době první diagnózy pSS je 56 let, přičemž další vrchol se vyskytuje mezi 20 a 40 lety. První příznaky se však mohou objevit i několik let před stanovením diagnózy. Spolehlivé epidemiologické údaje pro Německo zatím chybí. Předpokládá se, že celková prevalence Sjögrenova syndromu, včetně častější sekundární formy onemocnění, je nejméně 0,4 % (3).
Klinické projevy
Podle dosud největšího publikovaného souboru jsou sicca příznaky nejčastějším projevem Sjögrenova syndromu, a to až v 98 % případů (4). Pacienti s keratoconjunctivitis sicca (KCS) si stěžují na pocit cizího tělesa, pálení nebo bolestivost očí a zvýšenou citlivost na světlo. Výrazná xerostomie jako projev stomatitis sicca se klinicky projevuje obtížemi při delším mluvení a při žvýkání nebo insalivaci suché stravy. Ve srovnání s běžnou populací je u pacientů se Sjögrenovým syndromem přibližně dvakrát vyšší výskyt zubního kazu a časné ztráty zubů a jejich kvalita života související s orálním zdravím je výrazně snížena. Opakované infekce ústní dutiny způsobené bakterií Candida albicans se vyskytují 10krát častěji než v běžné populaci (5). Na druhou stranu se příznaky sicca běžně objevují s přibývajícím věkem a polyfarmaky: Přibližně 5-35 % běžné populace trpí suchostí očí (6) a přibližně 20 % pacientů se zubním onemocněním má suchost v ústech (7). Pro interpretaci těchto potíží je tedy zásadní důkladná anamnéza včetně léků a fyzikální vyšetření, po kterém následují speciální funkční testy. Tabulka 1 uvádí diferenciální diagnózy žlázových obtíží. Kromě toho je třeba věnovat pozornost dalším sicca symptomům, jako je suchý kašel při tracheobronchitis sicca nebo sicca symptomy v nosohltanu či genitálním traktu, projevující se zvýšenou náchylností k infekcím nebo jako dyspareunie.
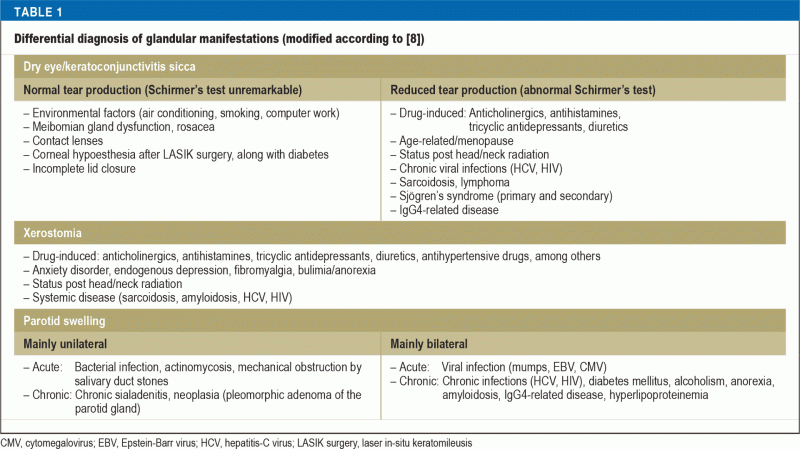
Až 34 % pacientů se Sjögrenovým syndromem uvádí epizodický nebo chronický, obvykle oboustranný otok příušních žláz (9). Zde je nezbytné vyloučit maligní nehodgkinský lymfom (NHL) B buněčné linie, který se vyskytuje přibližně u 5 % pacientů s pSS (10), u nichž je riziko vzniku NHL ve srovnání s běžnou populací výrazně zvýšené (poměr rizika : 13,7). Mezi hlavní prediktory rozvoje NHL patří nízká hladina komplementu (RR: 8,3), kryoglobulinemie (RR: 6,8), lymfadenopatie (RR: 3,7), histologický nález ektopických struktur podobných germinálnímu centru, trvalý otok příušní žlázy a kožní vaskulitida (10, 11). Tito pacienti patří do vysoce rizikové skupiny a vyžadují sledování v bližších intervalech a v případě potřeby další diagnostická vyšetření, jako je rentgenografie hrudníku a ultrazvuk břicha; platná doporučení pro screening lymfomů však nejsou k dispozici.
Nejčastějšími extraglandulárními projevy jsou artralgie a obvykle neerozivní polyartritida, které se vyskytují přibližně u 50 % pacientů (9). Plicní postižení mimo sicca komplex se obvykle projevuje jako intersticiální plicní onemocnění nebo folikulární bronchiolitida, obvykle po mnoha letech aktivity onemocnění (9-12 %) (9, 12). Asi 10 % pacientů má kožní postižení, většinou ve formě vaskulitidy s postižením malých a středních cév dolních končetin. Kromě toho se mohou objevit další méně časté kožní projevy, jako je prstenčitý erytém, urtikariální vaskulitida nebo hypergamaglobulinemická purpura (9). Postižení ledvin, které se vyskytuje přibližně u 5 % pacientů, je obvykle spojeno s tubulointersticiálními změnami, které často provází distální renální tubulární acidóza (RTA typu 1) s hypokalemickou svalovou hypotonií; glomerulonefritida je u pacientů s pSS vzácná (9, 13).
Klinický význam má také postižení periferního nervového systému, zejména v pozdějším průběhu onemocnění, které se typicky projevuje jako senzorická neuropatie (10-25 %) (9, 14). Vzácnější a náročnější na identifikaci jsou projevy v CNS; například diferenciální diagnóza multifokálních lézí CNS na MRI zahrnuje léze roztroušené sklerózy, které je obtížné odlišit od lézí pSS (15). V této souvislosti je důležitá koexistence pSS s poruchami spektra neuromyelitis optica (NMOSD), které jsou charakterizovány autoprotilátkami proti aquaporinu-4 (4). Pokud je u pacientů test na tuto protilátku pozitivní, má to velký diferenciálně terapeutický význam.
Naproti tomu nespecifické obtíže, jako je únava a difuzní bolest, se hodnotí obtížněji. Únava je však příznakem, který pacient pociťuje jako nejvíce obtěžující a který určuje četnost návštěv lékaře, kvalitu života i pracovní schopnost (16, e1). V diferenciální diagnóze únavy by měly být vyloučeny další stavy, jako je hypotyreóza, anémie a poruchy spánku, a měly by být zohledněny i obtíže při zvládání onemocnění.
Ženy s pozitivitou anti-Ro/SSA a anti-La/SSB toužící mít děti vyžadují zvláštní poradenství. Placentární přenos těchto protilátek může způsobit zánět s následnou sklerózou atrioventrikulárního (AV) uzlu, což s sebou nese riziko vzniku vrozené srdeční blokády u plodu. V 80 % případů dochází k úplné ireverzibilní srdeční blokádě a ve 20 % případů je významně zvýšena úmrtnost plodu (17). Týdenní ultrazvukové monitorování srdečního rytmu plodu mezi 16. a 31. týdnem těhotenství je nezbytné pro prognostické hodnocení i léčbu.
Prognóza
Prognóza Sjögrenova syndromu je celkově příznivá. Očekávaná délka života pacientů s pSS je srovnatelná s délkou života běžné populace (18). Kvalitu života pacientů však snižují různorodé projevy onemocnění. Hlavními příčinami úmrtí jsou kardiovaskulární onemocnění, infekce, solidní nádory a lymfomy. U pacientů se sSS je délka života dána primárním onemocněním.
Patogeneze
Stejně jako u většiny autoimunitních onemocnění není etiologie Sjögrenova syndromu dosud zcela objasněna (e2-e5, 19). Současné představy o jeho patogenezi jsou shrnuty na eObrázku.
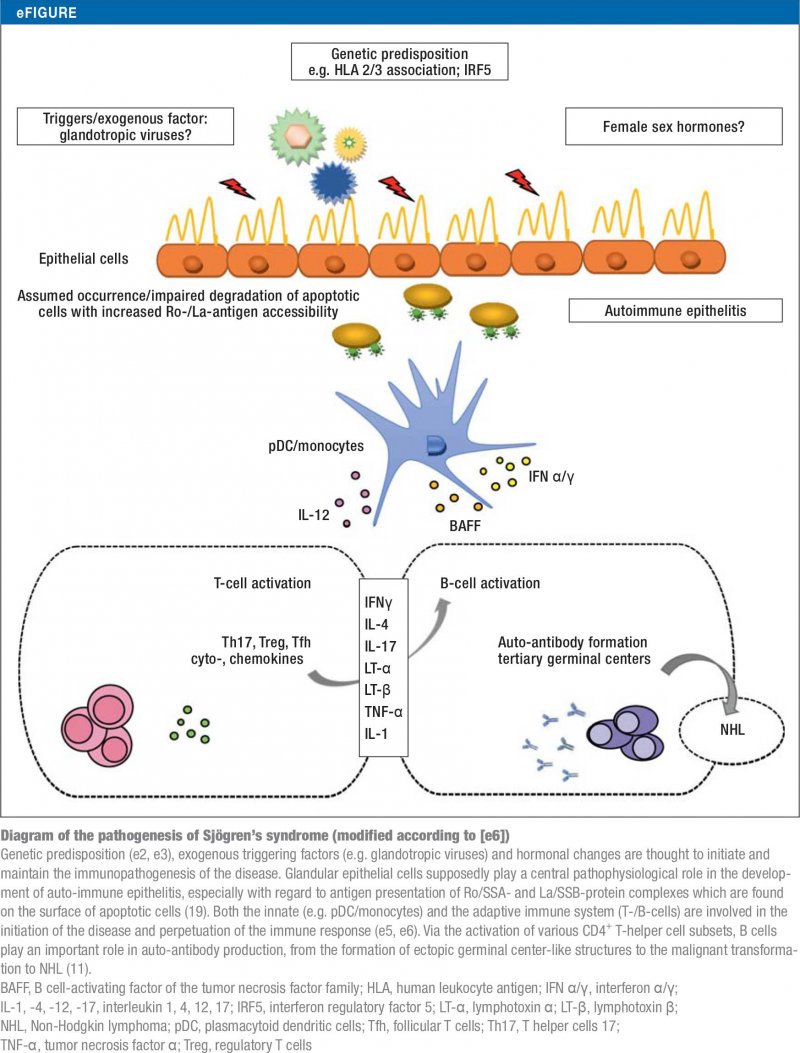
Klasifikační kritéria a diagnostické hodnocení
Od 70. let 20. století byla stanovena a vyhodnocena různá klasifikační kritéria. Nedávno byla stávající americká kritéria z roku 2012 poprvé začleněna do současné klasifikace hlavních společností ACR (American College of Rheumatology) a EULAR (European League Against Rheumatism). U pacientů, kteří mají příznaky sicca po dobu nejméně 3 měsíců, jsou založena na dalších funkčních testech (např. Schirmerův test) nebo sérologických (Anti-Ro/SSA) a histologických vyšetřeních (biopsie labiální slinné žlázy). Mezi těmito vyšetřeními mají protilátky anti-Ro/SSA a abnormální labiální biopsie slinné žlázy nejvyšší specificitu; jsou to tedy kritéria s nejvyššími hodnotami. Minimální skóre 4 umožňuje klasifikaci jako Sjögrenův syndrom (Box). Obrázek ukazuje diagnostický algoritmus pro Sjögrenův syndrom založený na revidovaných klasifikačních kritériích a různých projevech onemocnění.


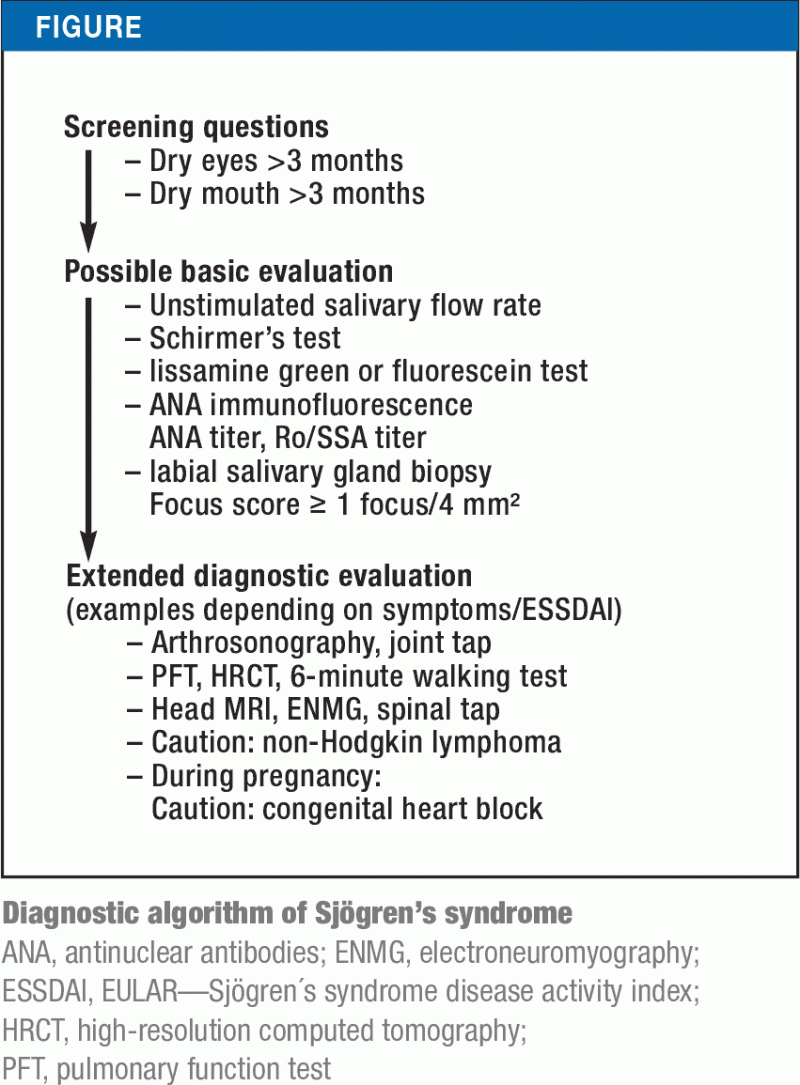

Objektivní testy na příznaky sicca
Schirmerův test a Saxonův test jsou snadno proveditelné, ale jejich výsledky nekorelují dobře se stížnostmi pacientů a měly by být hodnoceny v celkovém kontextu. Zde je zásadní spolupráce s oftalmologickým oddělením: K vizualizaci a hodnocení rohovkových a spojivkových lézí spojených s keratokonjunktivitidou sicca se používá lokální aplikace vitálních barviv (lissaminová zeleň nebo fluorescein). Přímé měření slinění je diagnostickým zlatým standardem, ale v každodenní klinické praxi je časově náročné. Parotidální sialografie a scintigrafie slinných žláz nemají dostatečnou specifičnost. Ultrasonografie hlavních slinných žláz jako neinvazivní metoda je nedílnou součástí každodenní klinické praxe. Tato metoda však zatím není dostatečně ověřena, aby mohla být zařazena do klasifikačních kritérií (21).
Laboratorní vyšetření
Imunofluorescenční vyšetření antinukleárních protilátek (ANA) má velký význam pro diagnostiku poruch pojivové tkáně. Až 83 % pacientů s pSS má pozitivní test na ANA (22). Nízký titr (23). U pacientů s pozitivním titrem ANA je jemný skvrnitý fluorescenční vzor silně indikující protilátky anti-Ro/SSA a/nebo anti-La/SSB, který je odhalen přibližně u 40-75 %, resp. 23-52 % pacientů s pSS (24). Vzhledem k nedávnému zvýšení diagnostické hodnoty přisuzované protilátkám anti-Ro/SSA v současném klasifikačním systému lze očekávat, že výrazně více nově klasifikovaných pacientů se Sjögrenovým syndromem bude mít zvýšené hladiny protilátek ve srovnání s historickými kohortami. Pozitivní titry protilátek korelují s časným nástupem onemocnění, intenzivnější tkáňovou infiltrací a vyšší prevalencí extraglandulárních projevů. Pozitivní testy na protilátky anti-Ro/SSA však mohou mít i pacienti s jinými poruchami pojivové tkáně. Zde je zásadní klinický kontext, zejména pro odlišení překrývajících se jednotek onemocnění. Zajímavé je, že sérologické autoimunitní jevy byly zjištěny až 20 let před výskytem prvních příznaků onemocnění (25). Mezi další sérologické abnormality patří přítomnost revmatoidních faktorů (60-75 %) a také polyklonální hypergamaglobulinemie jako známka zvýšené aktivity B buněk.
Vývoj biomarkerů, které poskytují prognostické informace a prostředek ke sledování progrese onemocnění, se nyní dostal do fáze etablování. Zvýšení beta2-mikroglobulinu a volných lehkých řetězců imunoglobulinů je spojeno se zvýšeným rizikem lymfomu (26). Siglec-1 se nedávno objevil jako nový biomarker. Tento nepřímý interferonový marker koreluje s vysokou aktivitou onemocnění i s extraglandulárními projevy (27).
Histopatologie
Histopatologický nález fokálních periduktálně lokalizovaných lymfocytárních infiltrátů v exokrinní žlázové tkáni spolu s jinak intaktními acinárními jednotkami je patognomonický pro Sjögrenův syndrom. Tyto infiltrace se většinou skládají z CD4+ T buněk, s některými dalšími CD8+ T buňkami a CD19+ B buňkami, plazmatickými buňkami a dendritickými buňkami. K odlišení Sjögrenova syndromu od jiných chorobných jednotek jsou nutné hluboké odborné znalosti v souladu s mezinárodními doporučeními pro interpretaci histopatologických nálezů (28). Minimální počet 50 monocytárních buněk/4 mm² byl definován jako skóre fokusu (FS) 1. Skóre fokusu ≥1 koreluje s fenotypovými charakteristikami Sjögrenova syndromu.
Léčba
Přes neustálý pokrok v našem chápání mechanismů podílejících se na patogenezi onemocnění není v současné době k dispozici cílená léčba Sjögrenova syndromu. O léčbě se rozhoduje individuálně podle aktivity onemocnění a přítomnosti a rozsahu extraglandulárních projevů. U pacientů se sSS je indikace k léčbě založena na základním onemocnění. Obecně platí, že léčbu by měl zajišťovat mezioborový tým zahrnující rodinné lékaře, revmatology, oftalmology a specialisty na ETN a také zubní lékaře. V závislosti na postiženém orgánu (orgánech) a projevujících se příznacích může být nutná konzultace dalších specialistů (gynekologa, pneumologa, neurologa atd.). Modifikující léčba je vyhrazena pro pacienty s extraglandulárním postižením. K měření systémové aktivity onemocnění byl vyvinut a validován index aktivity onemocnění EULAR Sjögrenova syndromu (ESSDAI) (29, e7).
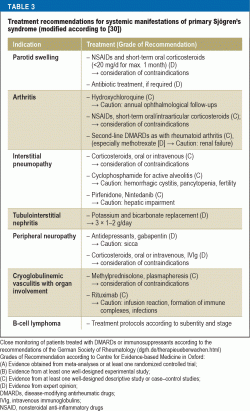
Léčba příznaků sicca
U většiny pacientů je hlavním cílem terapie zlepšení kvality života léčbou příznaků sicca a únavy. Zároveň je to pro lékaře velmi náročný úkol, protože možností léčby založených na důkazech je málo a většina terapeutických přístupů je pouze symptomatická (tabulka 2). Důležitou roli hraje edukace pacientů, která se zaměřuje na dodržování pravidel každodenního chování (30) – zaměřuje se na faktory prostředí (např. zvlhčování vzduchu), prevenci (např. fluorid pro prevenci zubního kazu, zanechání kouření) a vyhýbání se faktorům, které zvyšují únavu (např, spánková hygiena) a také fyzické kondici (aerobní vytrvalostní trénink proti únavě).
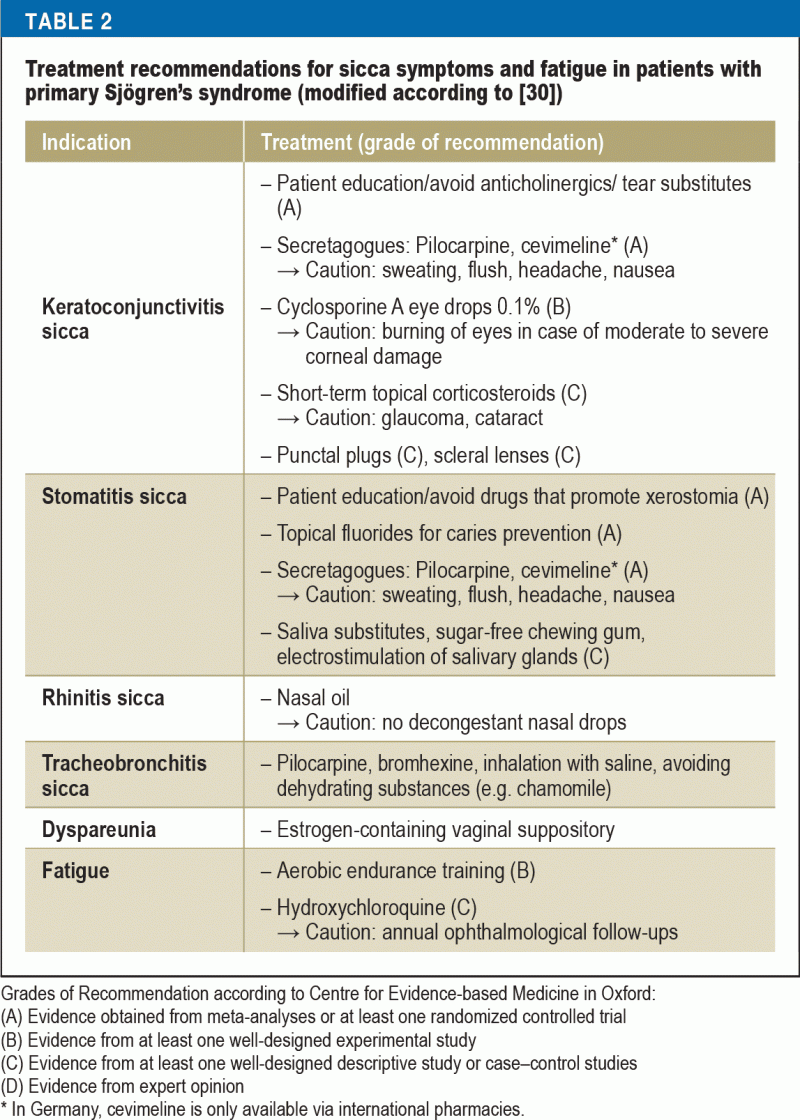
K léčbě keratokonjunktivitidy sicca jsou k dispozici různé náhražky slz. Složení slzných náhrad se liší v souladu s komplexní fyziologií třívrstvého předočnicového slzného filmu (lipidová vrstva, vodní vrstva a mucinová vrstva). Vzhledem k tomu, že v patogenezi suchého oka hrají ústřední roli imunitně zprostředkované mechanismy, získala protizánětlivá léčba očními kapkami s cyklosporinem A značný význam. Jejich účinnost byla prokázána v randomizovaných kontrolovaných studiích (RCT) a na základě údajů z těchto studií získala 0,1% kationická emulze cyklosporinu A registraci od Evropské lékové agentury (31). Mezi další opatření významně zvyšující kvalitu života těchto pacientů patří používání punkčních zátek a nasazování extra velkých kontaktních čoček („sklerálních čoček“) s funkcí uchovávání vody (32). Spolupráce s oftalmology je tedy nezbytná.
Xerostomii léčí společně zubní lékaři a otolaryngologové. Povrch ústní sliznice je poměrně velký a je třeba zvlhčovat různé struktury v ústní dutině (jazyk, zuby, dásně, ústní sliznice). Složení slin se navíc mění v závislosti na funkci a denní době. Optimální terapeutické kompenzace komplexních funkcí slin nelze dosáhnout. Dva systematické přehledy lokální/nefarmakologické léčby docházejí k závěru, že symptomy lze sice zmírnit, ale tok slin nelze zvýšit (33, 34). Stomatologická péče o pacienty s xerostomií je obzvláště náročná, protože nedostatek slin snižuje snášenlivost snímatelných zubních náhrad. Naopak u pacientů se Sjögrenovým syndromem se dosahuje dobrých výsledků při léčbě zubními implantáty (35).
Modifikující léčba
Rozhodnutí o zintenzivnění léčby závisí na aktivitě onemocnění a postiženém orgánovém systému. Několik RCT hodnotících použití konvenčních chorobu modifikujících antirevmatik (DMARDs) nebo biologických látek u pacientů se Sjögrenovým syndromem však nepřineslo přesvědčivé důkazy podporující jejich účinnost (30, 36). Rozhodnutí o léčbě jsou často založena na zkušenostech s příbuznými jednotkami revmatických onemocnění, jako je systémový lupus erythematodes. Analogicky k jiným onemocněním pojivové tkáně je hydroxychlorochin, látka s příznivým profilem vedlejších účinků, lékem volby pro různé mírné až středně závažné systémové projevy, jako jsou artralgie, artritida, kožní léze a únava. Příklad hydroxychlorochinu poukazuje na problémy týkající se návrhu studií a výběru pacientů, kteří mohou mít z léčby prospěch. Randomizovaná kontrolovaná studie na pSS nezjistila žádný rozdíl mezi hydroxychlorochinem und placebem, pokud jde o sicca symptomy, bolest a únavu po 24 týdnech (37). Tato studie však měla významná omezení: Aktivita onemocnění u těchto pacientů byla nízká, doba sledování krátká a primární cílový ukazatel nebyl validován. Pro zvýšení validity budoucích RCT zkoumajících toto heterogenní onemocnění je nezbytné rekrutovat reprezentativní skupiny pacientů a zvolit robustní primární koncové body.
Co se týče únavy, pilotní studie prokázala mírnou účinnost rituximabu (38). Bohužel to nepotvrdila velká RCT provedená o několik let později (39).
Léčebná doporučení s ohledem na imunosupresi se liší podle orgánového postižení (tabulka 3). U pacientů se závažnými orgánovými projevy má prokázanou účinnost použití vysokých dávek metylprednisolonu a cyklofosfamidu. U těžké vaskulitidy, zejména při současné kryoglobulinemii, jsou doporučenými možnostmi léčby rituximab nebo plazmaferéza. U pacientů s NHL se léčba volí na základě subentity a stadia podle současných pokynů pro léčbu hematoonkologických onemocnění.
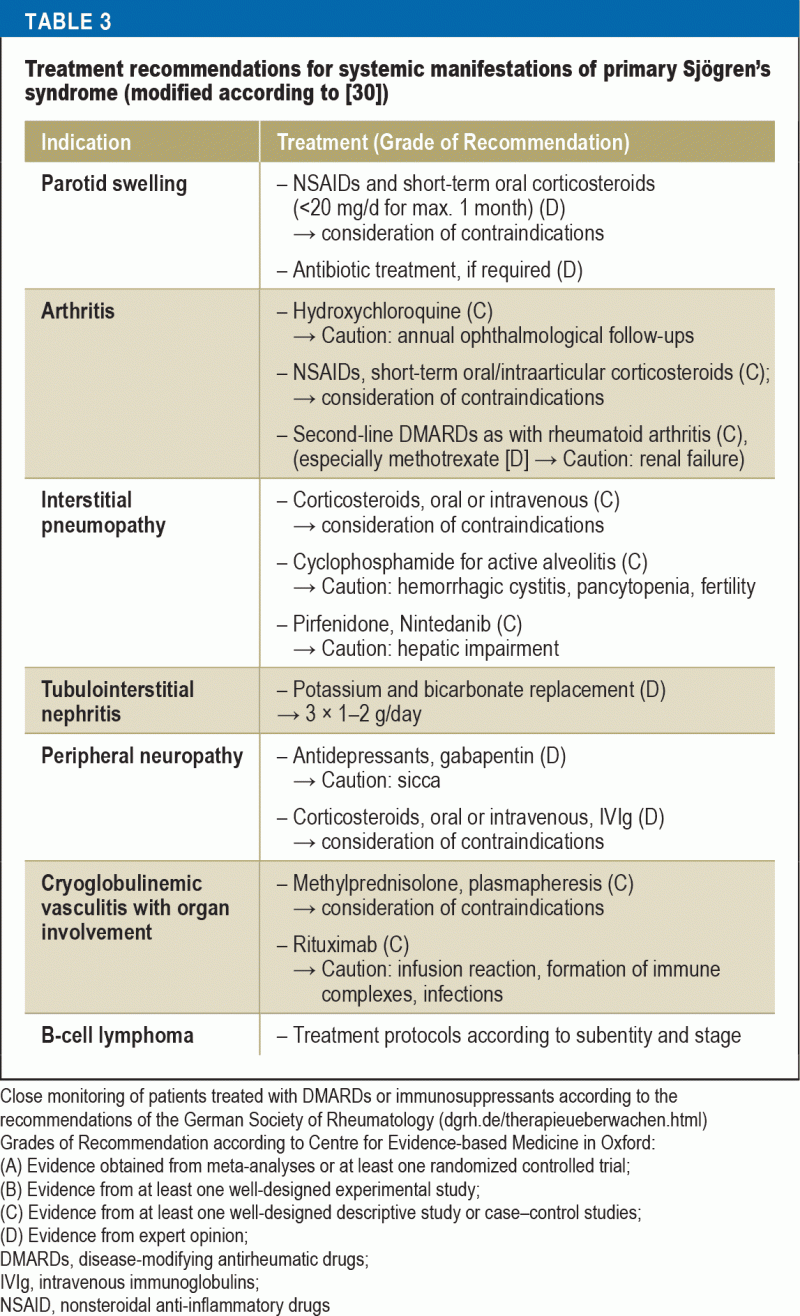
Doporučenou léčbou pro těhotné ženy se Sjögrenovým syndromem a vysokým rizikem vrozené srdeční blokády je hydroxychlorochin, aby se minimalizovalo riziko; toto doporučení je však založeno pouze na důkazech z retrospektivních studií (40).
V současné době se v RCT s validovanými nástroji (ESSDAI) hodnotí nové léčebné přístupy zaměřené na patofyziologické mechanismy: modulace hyperaktivity B-buněk (např, belimumab), antagonizace ko-stimulace T-buněk (např. abatacept), efektorové cytokiny (např. interleukin-6-receptor/tocilizumab; interferon α/anifrolumab), jakož i prevence tvorby ektopických struktur podobných zárodečným centrům (např. blokáda lymfotoxinu-βR). Tyto studie stojí před úkolem prokázat účinnost u tří komplexů symptomů – sicca, únavy a extraglandulárních projevů.
Prohlášení o střetu zájmů
Prof. Dörner obdržel honoráře za konzultace od společností UCB, Novartis a Roche a finanční podporu na provádění klinických studií od společností UCB a Novartis.
Prof. Pleyer obdržel honoráře za konzultace a přednášky od společností Santen, Théa a Allergan.
Prof. Burmester obdržel finanční podporu na provádění klinických studií od společností Novartis, UCB a Roche.
Dr. Stefanski, Dr. Tomiak a Prof. Dietrich prohlašují, že nejsou ve střetu zájmů.
Manuskript přijat 13. prosince 2016; revidovaná verze přijata 14. března 2017
Z německého originálu přeložil Dr. Ralf Thoene.
Odpovídající autor
Dr. med. Ana-Luisa Stefanski
Charite Universitatsmedizin Berlin
Rheumatologie und klinische Immunologie
Charitéplatz 1
10117 Berlín, Německo
[email protected]
Doplňkový materiál
Pro eReference viz:
www.aerzteblatt-international.de/ref2017
eObrázek:
www.aerzteblatt-international.de/17m0354
.