Diagnosticul și tratamentul sindromului Sjögren
Principiu: Sindromul Sjögren este una dintre cele mai frecvente boli reumatologice inflamatorii, cu o prevalență de cel puțin 0,4% în Germania.
Metode: Această recenzie se bazează pe articole pertinente recuperate printr-o căutare selectivă în PubMed. O atenție deosebită este acordată criteriilor de clasificare actualizate și recomandărilor actuale de tratament.
Rezultate: Sindromul Sjögren are o mare varietate de prezentări, de la afectarea locală a glandelor exocrine cu keratoconjunctivită sicca și xerostomie (semnele principale ale bolii) până la afectarea sistemică, extraglandulară a mai multor organe. De asemenea, oboseala înrăutățește considerabil calitatea vieții pacienților. Testele serologice evidențiază autoanticorpi antinucleari (anti-Ro/SSA și anti-La/SSB), precum și factori reumatoizi. Semnul histologic distinctiv al bolii este infiltrarea limfocitară focală în acini glandulari cu aspect altfel normal. De asemenea, boala crește semnificativ riscul de apariție a limfomului non-Hodgkin din seria celulelor B, care apare la aproximativ 5% dintre pacienți. Sindromul Sjögren primar (pSS) diferă de forma secundară (sSS), care apare în cadrul unei alte boli autoimune, în special lupusul eritematos sistemic (15-36%), artrita reumatoidă (20-32%) și scleroza sistemică limitată sau progresivă (11-24%). Terapia modificatoare de boală este rezervată pacienților cu afectare sistemică; există dovezi limitate privind eficacitatea acesteia. Din cauza complexității acestei boli, unele dintre manifestările sale clinice pot necesita un tratament interdisciplinar.
Concluzie: Principalele considerente în îngrijirea interdisciplinară a pacienților cu boala Sjögren sunt măsurile de îmbunătățire a calității vieții, tratamentele farmacologice și non-farmacologice pentru a ține sub control activitatea bolii și managementul riscului de limfom. Abordările terapeutice viitoare trebuie să țină cont de eterogenitatea bolii.
![]()
![]()
Sindromul Sjögren este o boală autoimună inflamatorie cronică de origine necunoscută, care atacă în special glandele lacrimale și salivare. Simptomele siccative sunt semnele distinctive ale bolii, care se poate prezenta și cu diverse manifestări de organ. Din cauza varietății largi de semne și simptome, pacienții cu sindromul Sjögren pot consulta la prima consultație o gamă variată de practicieni din domeniul sănătății, inclusiv medici de familie, oftalmologi, specialiști ORL și dentiști. Astfel, este crucial ca medicii de diferite specialități să fie informați cu privire la aspectele actuale ale manifestărilor clinice ale bolii, la criteriile de clasificare revizuite și la opțiunile actuale de tratament.
Sindromul Sjögren primar (pSS) se distinge de sindromul Sjögren secundar (sSS), care apare ca parte a altor boli autoimune. sSS coexistă în special cu lupusul eritematos sistemic (15-36%), artrita reumatoidă (20-32%), precum și cu scleroza sistemică limitată și progresivă (11-24%), mai puțin frecvent cu scleroza multiplă și cu hepatita și tireoidita autoimune (1). Aici, termenul „secundar” nu descrie o secvență cronologică de manifestare a bolii: Afecțiunea subiacentă se poate prezenta inițial cu simptome de sicca și se poate dezvălui abia mai târziu, pe parcursul evoluției bolii. Stabilirea diagnosticului este adesea o provocare la pacienții cu entități patologice care se suprapun. Având în vedere evoluțiile distincte ale bolii (inclusiv prognosticul), este important să se facă diferența între forma primară și cea secundară a sindromului Sjögren.
Epidemiologie
Eterogenitatea datelor disponibile privind prevalența și incidența sindromului Sjögren se explică prin diferențele în ceea ce privește designul studiilor și criteriile de clasificare. Prevalența globală calculată pentru pSS, mai rar, este de 61 la 100 000 de locuitori, cea mai mare prevalență fiind întâlnită în Europa (2). Femeile dezvoltă sindromul Sjögren semnificativ mai frecvent decât bărbații; diferența de sex variază între 9:1 și 19:1. Vârsta medie la momentul primului diagnostic de pSS este de 56 de ani, cu un alt vârf de vârstă care apare între 20 și 40 de ani. Cu toate acestea, primele simptome pot apărea cu ani înainte de diagnostic. Deocamdată, lipsesc date epidemiologice fiabile pentru Germania. Se presupune că prevalența globală a sindromului Sjögren, inclusiv a formei secundare mai frecvente a bolii, este de cel puțin 0,4% (3).
Manifestare clinică
Conform celei mai mari cohorte publicate până în prezent, simptomele sicca sunt cea mai frecventă manifestare a sindromului Sjögren, cu până la 98% din cazuri (4). Pacienții cu keratoconjunctivită sicca (KCS) se plâng de senzația de corp străin, arsură sau durere la nivelul ochilor și sensibilitate crescută la lumină. Xerostomia marcată, ca semn al stomatitei sicca, se prezintă clinic prin dificultăți la vorbirea pe perioade îndelungate de timp și la mestecarea sau insalivarea alimentelor uscate. Comparativ cu populația generală, prevalența cariilor dentare și a pierderii timpurii a dinților este de aproximativ două ori mai mare la pacienții cu sindromul Sjögren, iar calitatea vieții lor legată de sănătatea orală este semnificativ redusă. Infecțiile orale recurente cu Candida albicans apar de 10 ori mai frecvent decât în populația generală (5). Pe de altă parte, simptomele sicca sunt frecvent raportate odată cu înaintarea în vârstă și polifarmacia: Aproximativ 5% până la 35% din populația generală suferă de uscăciunea ochilor (6), iar aproximativ 20% dintre pacienții stomatologi se confruntă cu uscăciunea gurii (7). Astfel, o anamneză amănunțită, inclusiv a medicamentelor, și un examen fizic, urmat de teste funcționale speciale, sunt esențiale pentru interpretarea acestor plângeri. Tabelul 1 enumeră diagnosticele diferențiale pentru afecțiunile glandulare. În plus, trebuie acordată atenție și altor simptome sicca, cum ar fi tusea uscată în traheobronșita sicca sau simptomele sicca în nazofaringe sau în tractul genital, care se manifestă ca o susceptibilitate crescută la infecții sau ca dispareunie.
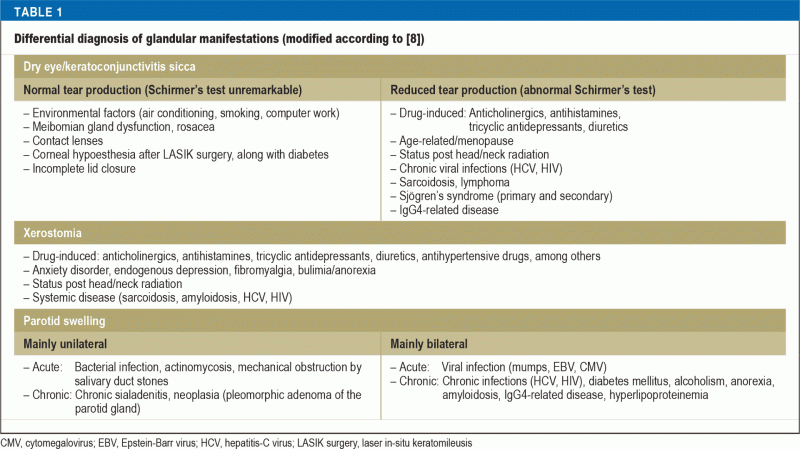
Până la 34% dintre pacienții cu sindromul Sjögren raportează umflarea episodică sau cronică, de obicei bilaterală, a glandelor parotide (9). În acest caz, este esențial să se excludă limfomul malign non-Hodgkin (NHL) de linie de celule B, care apare la aproximativ 5% dintre pacienții cu pSS (10), care prezintă un risc semnificativ mai mare de a dezvolta NHL în comparație cu populația generală (raport de risc : 13,7). Principalii factori predictivi pentru dezvoltarea NHL includ niveluri scăzute ale complementului (RR: 8,3), crioglobulinemie (RR: 6,8), limfadenopatie (RR: 3,7), constatarea histologică a unor structuri ectopice asemănătoare centrelor germinale, umflarea permanentă a glandei parotide și vasculita cutanată (10, 11). Acești pacienți aparțin unui grup cu risc ridicat și necesită o monitorizare la intervale mai apropiate și, dacă este necesar, investigații diagnostice suplimentare, cum ar fi radiografia toracică și ecografia abdominală; cu toate acestea, nu sunt disponibile recomandări valabile pentru screeningul limfomului.
Cele mai frecvente manifestări extraglandulare sunt artralgia și o poliartrită, de obicei neerozivă, care apar la aproximativ 50% dintre pacienți (9). Implicarea pulmonară dincolo de complexul sicca se manifestă de obicei ca o boală pulmonară interstițială sau bronșiolită foliculară, în mod normal după mulți ani de activitate a bolii (9-12%) (9, 12). Aproximativ 10% dintre pacienți prezintă leziuni cutanate, majoritatea sub forma unei vasculite cu afectarea vaselor mici și mijlocii de la nivelul membrelor inferioare. În plus, pot apărea și alte manifestări cutanate mai puțin frecvente, cum ar fi eritemul inelar, vasculita urticariană sau purpura hipergammaglobulinemică (9). Afectarea renală, care se întâlnește la aproximativ 5% dintre pacienți, este de obicei asociată cu modificări tubulointerstițiale care se însoțesc frecvent de acidoză tubulară renală distală (ATR tip 1) cu hipotonie musculară hipokaliemică; glomerulonefrita este rară la pacienții cu pSS (9, 13).
De asemenea, de relevanță clinică este implicarea sistemului nervos periferic, în special mai târziu în cursul bolii, manifestându-se în mod tipic ca neuropatie senzorială (10-25%) (9, 14). Mai rare și mai dificil de identificat sunt manifestările SNC; de exemplu, diagnosticul diferențial al leziunilor multifocale ale SNC la IRM include leziuni de scleroză multiplă, care sunt dificil de distins de leziunile pSS (15). În acest context, este importantă coexistența pSS cu tulburările din spectrul neuromielitei optice (NMOSD), care se caracterizează prin autoanticorpi împotriva aquaporinei-4 (4). Dacă pacienții sunt testați pozitiv pentru acest anticorp, acest lucru are o mare importanță terapeutică diferențială.
În schimb, plângerile nespecifice, cum ar fi oboseala și durerea difuză, sunt mai dificil de evaluat. Cu toate acestea, oboseala este simptomul resimțit ca fiind cel mai supărător de către pacient, determinând frecvența vizitelor la medic, calitatea vieții, precum și aptitudinea pentru muncă (16, e1). Trebuie excluse alte afecțiuni din diagnosticul diferențial al oboselii, cum ar fi hipotiroidismul, anemia și tulburările de somn, și trebuie luate în considerare și dificultățile de a face față bolii.
Femeile anti-Ro/SSA- și anti-La/SSB-pozitive care doresc să aibă copii necesită consiliere specială. Transmiterea placentară a acestor anticorpi poate determina o inflamație cu scleroză ulterioară a nodulului atrioventricular (AV) care prezintă riscul ca fătul să dezvolte un bloc cardiac congenital. În 80% din cazuri, apare un bloc cardiac complet ireversibil, iar în 20% dintre cazuri mortalitatea fetală este semnificativ crescută (17). Monitorizarea ultrasonografică săptămânală a ritmului cardiac al fătului între 16 și 31 de săptămâni de gestație este esențială atât pentru evaluarea prognostică, cât și pentru management.
Prognostic
În general, prognosticul sindromului Sjögren este favorabil. Speranța de viață a pacienților cu pSS este comparabilă cu cea a populației generale (18). Cu toate acestea, calitatea vieții pacienților este redusă de diversele manifestări ale bolii. Bolile cardiovasculare, infecțiile, tumorile solide și limfomul sunt principalele cauze de deces. La pacienții cu sSS, speranța de viață este determinată de boala primară.
Patogenie
Ca în cazul majorității bolilor autoimune, etiologia sindromului Sjögren nu este încă pe deplin înțeleasă (e2-e5, 19). Conceptele actuale ale patogenezei sale sunt rezumate în eFigura.
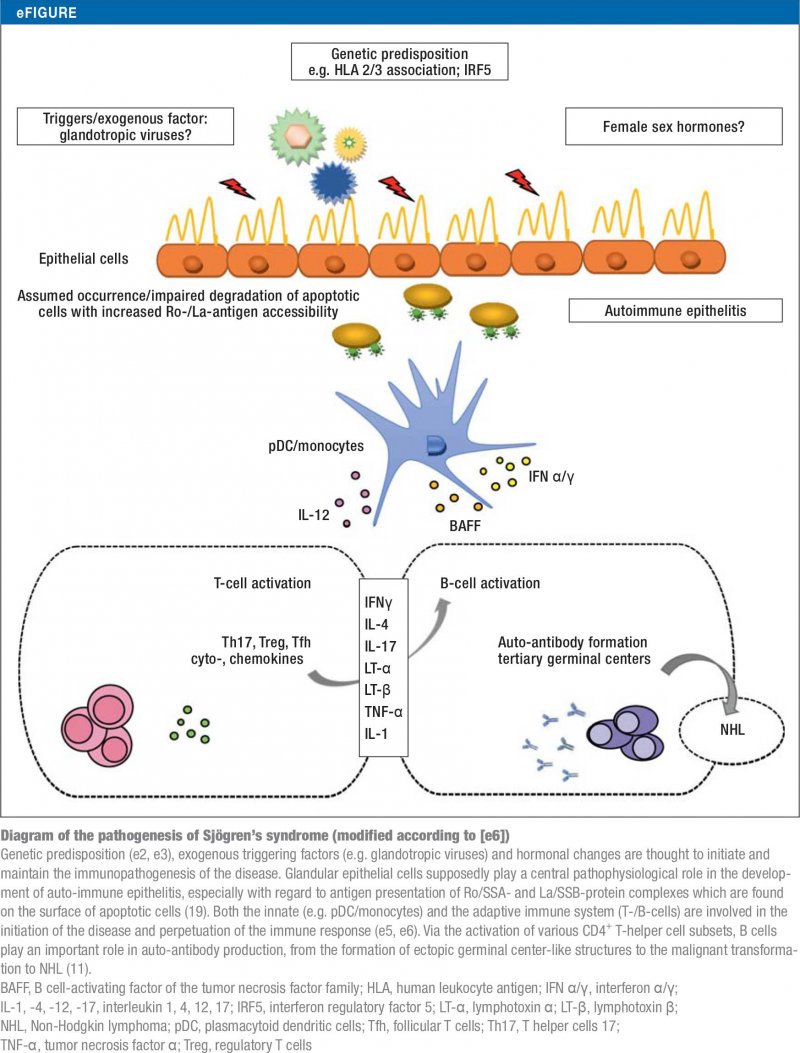
Criterii de clasificare și evaluare a diagnosticului
Din anii 1970, au fost stabilite și evaluate diverse criterii de clasificare. Recent, criteriile existente în SUA din 2012 au fost integrate pentru prima dată în clasificarea actuală de către principalele societăți, ACR (American College of Rheumatology) și EULAR (European League Against Rheumatism). La pacienții care au prezentat simptome de sicca timp de cel puțin 3 luni, acestea se bazează pe teste funcționale suplimentare (de exemplu, testul Schirmer) sau examene serologice (Anti-Ro/SSA) și histologice (biopsie labială a glandelor salivare). Dintre aceste investigații, anticorpii anti-Ro/SSA și o biopsie anormală a glandei salivare labiale au cea mai mare specificitate; în consecință, acestea sunt criteriile cu cele mai mari valori. Un scor minim de 4 permite clasificarea ca sindrom Sjögren (Caseta). Figura prezintă un algoritm de diagnostic pentru sindromul Sjögren, bazat pe criteriile de clasificare revizuite și pe diferitele manifestări ale bolii.


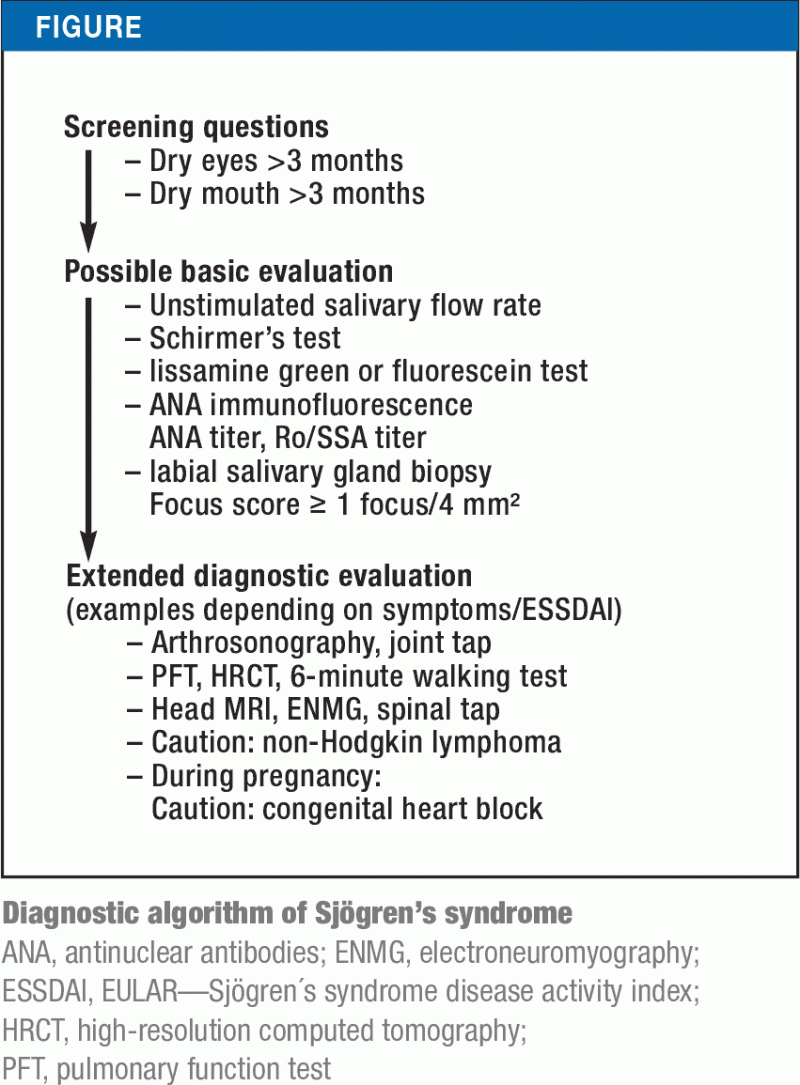

Testele obiective pentru simptomele sicca
Testul lui Chirmer și testul lui Saxon sunt ușor de efectuat, dar rezultatele lor nu se corelează bine cu plângerile pacienților și trebuie evaluate în contextul general. În acest caz, cooperarea cu departamentul de oftalmologie este crucială: Aplicarea topică a coloranților vitali (verde lissamine sau fluoresceină) este utilizată pentru a vizualiza și clasifica leziunile corneenei și conjunctivale asociate cu keratoconjunctivita sicca. Măsurarea directă a salivației este standardul de aur al diagnosticului, dar consumă timp în practica clinică zilnică. Sialografia parotidiană și scintigrafia glandelor salivare nu au o specificitate suficientă. Fiind o metodă neinvazivă, ultrasonografia glandelor salivare majore face parte integrantă din practica clinică zilnică. Cu toate acestea, metoda nu este încă suficient de validată pentru a fi inclusă în criteriile de clasificare (21).
Testări de laborator
Testarea prin imunofluorescență a anticorpilor antinucleari (ANA) este foarte relevantă pentru diagnosticul tulburărilor de țesut conjunctiv. Până la 83% dintre pacienții cu pSS sunt testați pozitiv pentru ANA (22). Cu toate acestea, un titru scăzut (23). La pacienții cu titruri ANA pozitive, un model de fluorescență cu pete fine este puternic indicativ pentru anticorpii anti-Ro/SSA și/sau anti-La/SSB, care este evidențiat la aproximativ 40% până la 75% și, respectiv, 23% până la 52% dintre pacienții cu pSS (24). Având în vedere creșterea recentă a valorii diagnostice atribuite anticorpilor anti-Ro/SSA în actualul sistem de clasificare, este de așteptat ca un număr semnificativ mai mare de pacienți cu sindrom Sjögren nou clasificați să aibă niveluri ridicate de anticorpi în comparație cu cohortele istorice. Titlurile pozitive de anticorpi se corelează cu debutul precoce al bolii, cu o infiltrare tisulară mai intensă și cu o prevalență mai mare a manifestărilor extraglandulare. Cu toate acestea, pacienții cu alte afecțiuni ale țesutului conjunctiv pot fi, de asemenea, testați pozitiv pentru anticorpii anti-Ro/SSA. În acest caz, contextul clinic este vital, în special pentru a diferenția între entități patologice care se suprapun. Este interesant faptul că fenomenele autoimune serologice au fost detectate cu până la 20 de ani înainte de apariția primelor semne și simptome ale bolii (25). Alte anomalii serologice includ prezența factorilor reumatoizi (60-75%), precum și hipergamaglobulinemia policlonală ca semn al unei activități crescute a celulelor B.
Dezvoltarea biomarkerilor, care oferă informații prognostice și un mijloc de monitorizare a evoluției bolii, a ajuns acum în faza de stabilire. O creștere a beta2-microglobulinei și a lanțurilor ușoare libere ale imunoglobulinelor este asociată cu un risc crescut de limfom (26). Siglec-1 a apărut recent ca un nou biomarker. Acest marker indirect al interferonului se corelează cu un nivel ridicat de activitate a bolii, precum și cu manifestări extraglandulare (27).
Histopatologie
Constatarea histopatologică a infiltratelor limfocitare focale localizate periductal în țesutul glandular exocrin, împreună cu unități acinare altfel intacte, este patognomonică pentru sindromul Sjögren. Aceste infiltrații constau în principal din celule T CD4+, cu câteva celule T CD8+ suplimentare și celule B CD19+, plasmocite și celule dendritice. Este necesară o expertiză aprofundată, în conformitate cu recomandările internaționale privind interpretarea rezultatelor histopatologice, pentru a diferenția sindromul Sjögren de alte entități patologice (28). Un număr minim de 50 de celule monocitice/4 mm² a fost definit ca un scor de focar (FS) de 1. Un scor de focar ≥1 se corelează cu caracteristicile fenotipice ale sindromului Sjögren.
Management
În ciuda progreselor continue în înțelegerea mecanismelor implicate în patogeneza bolii, un tratament țintit al sindromului Sjögren nu este disponibil în prezent. Tratamentul este decis în mod individual, în funcție de activitatea bolii și de prezența și amploarea manifestărilor extraglandulare. La pacienții cu sSS, indicația pentru tratament se bazează pe boala de bază. În general, tratamentul ar trebui să fie asigurat de o echipă interdisciplinară, incluzând medici de familie, reumatologi, oftalmologi și specialiști ETN, precum și dentiști. În funcție de organul (organele) implicat(e) și de simptomele prezentate, poate fi necesară consultarea altor specialiști (ginecologi, pneumologi, neurologi etc.). Terapia modificatoare a bolii este rezervată pacienților cu afectare extraglandulară. Pentru a măsura activitatea sistemică a bolii, a fost dezvoltat și validat EULAR Sjögren’s Syndrome Disease Activity Index (ESSDAI) (29, e7).
Managementul simptomelor sicca
La majoritatea pacienților, scopul principal al terapiei este îmbunătățirea calității vieții prin tratarea simptomelor sicca și de oboseală. În același timp, aceasta este o sarcină foarte dificilă pentru medici, deoarece opțiunile de tratament bazate pe dovezi sunt puține și majoritatea abordărilor terapeutice sunt doar simptomatice (tabelul 2). Educația pacientului joacă un rol important, concentrându-se pe respectarea regulilor comportamentale de zi cu zi (30) – vizând factorii de mediu (de exemplu, umidificarea aerului), prevenția (de exemplu, fluor pentru prevenirea cariilor, renunțarea la fumat) și evitarea factorilor care cresc oboseala (de ex, igiena somnului), precum și condiția fizică (antrenament de anduranță aerobică pentru combaterea oboselii).
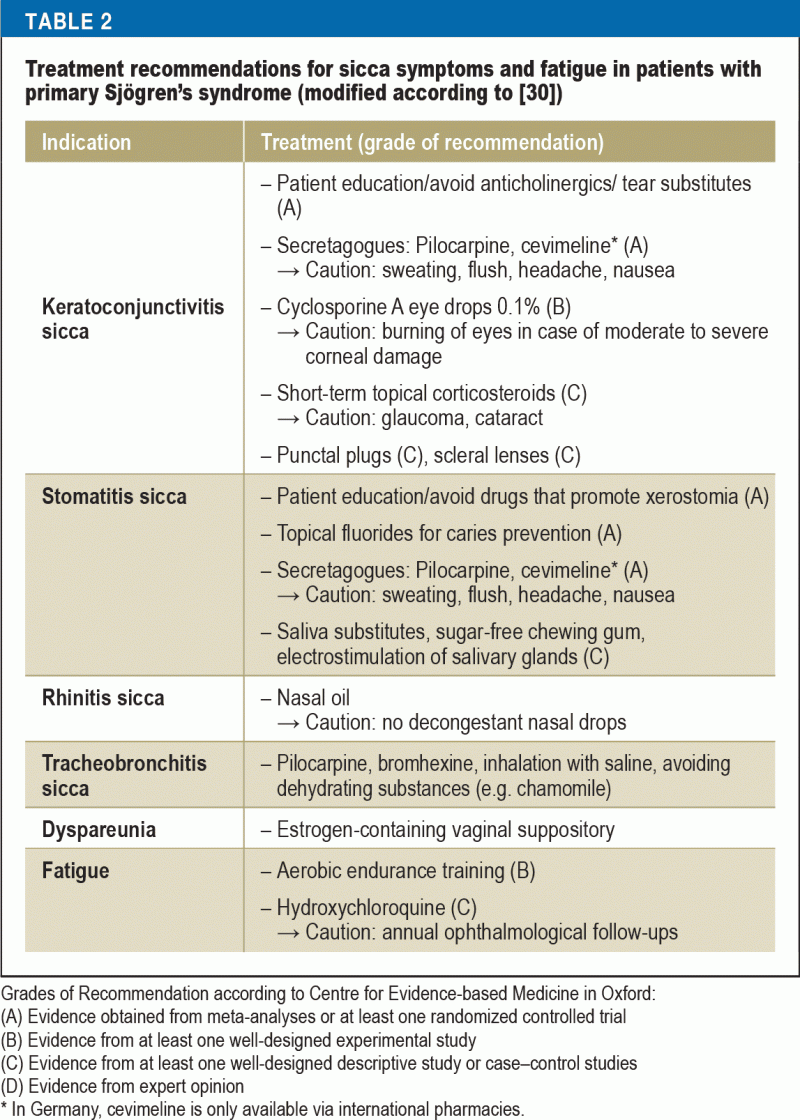
Diferiți înlocuitori lacrimali sunt disponibili pentru tratarea keratoconjunctivitei sicca. Compoziția substituenților lacrimali variază în funcție de fiziologia complexă a filmului lacrimal preocular cu trei straturi (strat lipidic, strat apos și strat de mucină). Deoarece mecanismele mediate imunitar joacă un rol central în patogeneza ochiului uscat, tratamentul antiinflamator cu picături oculare de ciclosporină A a căpătat o importanță semnificativă. Eficacitatea acestora a fost dovedită în studii controlate randomizate (RCT) și, pe baza datelor din aceste studii, emulsia cationică de ciclosporină A 0,1% a primit autorizația de introducere pe piață din partea Agenției Europene pentru Medicamente (31). Printre măsurile suplimentare care cresc semnificativ calitatea vieții acestor pacienți se numără utilizarea de dopuri puncale și montarea de lentile de contact extra-largi („lentile sclerale”) cu funcție de stocare a apei (32). Astfel, cooperarea cu oftalmologii este esențială.
Xerostomia este tratată în comun de către stomatologi și otorinolaringologi. Suprafața mucoasei bucale este comparativ mare și trebuie umezite diferite structuri din cavitatea bucală (limba, dinții, gingia, mucoasa bucală). În plus, compoziția salivei variază în funcție de funcție și de momentul zilei. Nu se poate obține o compensare terapeutică optimă a funcțiilor complexe ale salivei. Două analize sistematice privind tratamentele topice/non-farmacologice ajung la concluzia că, deși simptomele pot fi ameliorate, fluxul de salivă nu poate fi crescut (33, 34). Îngrijirea dentară pentru pacienții cu xerostomie este deosebit de dificilă, deoarece lipsa salivei reduce tolerabilitatea restaurărilor dentare detașabile. În schimb, la pacienții cu sindromul Sjögren se obțin rezultate bune cu tratamentul cu implanturi dentare (35).
Terapie de modificare a bolii
Decizia de intensificare a tratamentului depinde de activitatea bolii și de sistemul de organe implicat. Cu toate acestea, cele câteva RCT care au evaluat utilizarea medicamentelor antireumatice convenționale modificatoare de boală (DMARD) sau a agenților biologici la pacienții cu sindromul Sjögren nu au furnizat dovezi concludente care să susțină eficacitatea acestora (30, 36). Deciziile privind tratamentul se bazează frecvent pe experiențele cu entități de boli reumatice înrudite, cum ar fi lupusul eritematos sistemic. Analog altor afecțiuni ale țesutului conjunctiv, hidroxiclorochina, un agent cu un profil favorabil de efecte secundare, este medicamentul de elecție pentru diverse manifestări sistemice ușoare până la moderate, cum ar fi artralgia, artrita, leziunile cutanate și oboseala. Exemplul hidroxiclorochina evidențiază provocările în ceea ce privește proiectarea studiilor și selecția pacienților care pot beneficia de tratament. Un studiu randomizat și controlat privind pSS nu a constatat nicio diferență între hidroxicloroquină și placebo în ceea ce privește simptomele sicca, durerea și oboseala după 24 de săptămâni (37). Cu toate acestea, acest studiu a avut limitări semnificative: Activitatea bolii la acești pacienți a fost scăzută, perioada de urmărire a fost scurtă, iar punctul final primar nu a fost validat. Pentru a crește validitatea viitoarelor RCT care investighează această boală eterogenă, este esențial să se recruteze grupuri reprezentative de pacienți și să se selecteze criterii de evaluare primare solide.
În ceea ce privește oboseala, un studiu pilot a demonstrat o eficacitate moderată pentru rituximab (38). Din nefericire, acest lucru nu a fost confirmat de un ECR de mari dimensiuni efectuat câțiva ani mai târziu (39).
Recomandările de tratament în ceea ce privește imunosupresia variază în funcție de afectarea organelor (tabelul 3). La pacienții cu manifestări severe de organ, utilizarea de doze mari de metilprednisolon și ciclofosfamidă este de o eficacitate dovedită. Pentru vasculita severă, în special cu crioglobulinemie concomitentă, rituximab sau plasmafereza sunt opțiunile de tratament recomandate. La pacienții cu LNH, tratamentul este ales în funcție de subentitate și de stadiu, în conformitate cu orientările actuale privind tratamentul afecțiunilor hemato-oncologice.
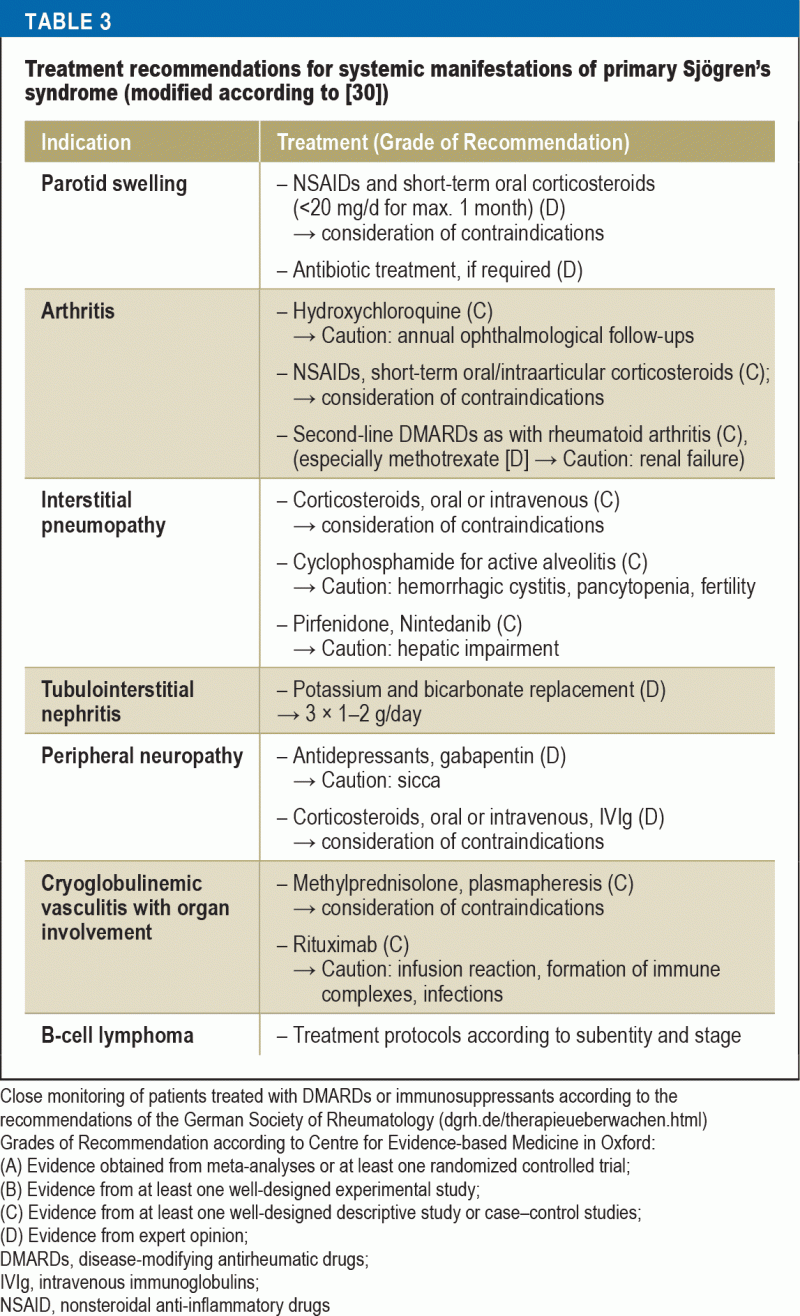
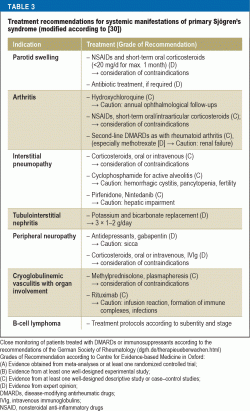
Tratamentul recomandat pentru femeile gravide cu sindromul Sjögren și un risc ridicat de bloc cardiac congenital este hidroxiclorochina pentru a minimiza riscul; cu toate acestea, această recomandare se bazează numai pe dovezi din studii retrospective (40).
Noi abordări terapeutice, care vizează mecanisme fiziopatologice, sunt în prezent evaluate în cadrul unor RCT cu instrumente validate (ESSDAI): modularea hiperactivității celulelor B (de ex, belimumab), antagonizarea co-stimulării celulelor T (de exemplu, abatacept), citokine efectoare (de exemplu, interleukina-6-receptor/tocilizumab; interferon α/anifrolumab), precum și prevenirea formării structurilor ectopice asemănătoare centrelor germinale (de exemplu, blocarea limfotoxinei-βR). Aceste studii se confruntă cu provocarea de a demonstra eficacitatea pentru cele trei complexe de simptome-sicca, oboseală și manifestări extraglandulare.
Declarație privind conflictul de interese
Prof. Dörner a primit onorarii de consultanță de la UCB, Novartis și Roche, precum și sprijin financiar pentru desfășurarea studiilor clinice de la UCB și Novartis.
Prof. Pleyer a primit onorarii de consultanță și conferințe de la Santen, Théa și Allergan.
Prof. Burmester a primit sprijin financiar pentru efectuarea de studii clinice de la Novartis, UCB și Roche.
Dr. Stefanski, Dr. Tomiak și Prof. Dietrich declară că nu există niciun conflict de interese.
Manuscrisul a fost primit la 13 decembrie 2016; versiunea revizuită a fost acceptată la 14 martie 2017
Traducerea din originalul german de Ralf Thoene, MD.
Autorul corespondent
Dr. med. Ana-Luisa Stefanski
Charite Universitatsmedizin Berlin
Rheumatologie und klinische Immunologie
Charitéplatz 1
10117 Berlin, Germania
[email protected]
Material suplimentar
Pentru referințe electronice vă rugăm să consultați:
www.aerzteblatt-international.de/ref2017
eFigură:
www.aerzteblatt-international.de/17m0354
.