Leczenie choroby HIV za pomocą terapii komórkami macierzystymi
Science Highlights by Ann A. Kiessling, PhD
- Pobierz lub wydrukuj ten artykuł jako PDF
Co to jest choroba HIV?
Człowieczy wirus niedoboru odporności (HIV) infekuje określone typy komórek układu odpornościowego. Podobnie jak większość wirusów, aby wirus HIV mógł zainfekować komórkę, musi związać się ze specyficznym białkiem, zwanym receptorem, znajdującym się na powierzchni komórki. W naszym układzie odpornościowym istnieje wiele różnych typów komórek, a każda z nich odgrywa specyficzną rolę w zwalczaniu infekcji, zarówno bakteryjnych, jak i wirusowych. Nasze ciała produkują codziennie miliardy nowych komórek odpornościowych z rezerwuarów komórek macierzystych w szpiku kostnym.
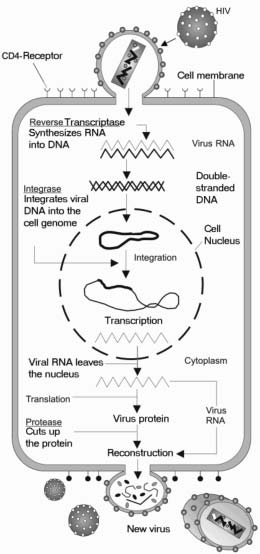
HIV ma złożony cykl życiowy, który obejmuje włączenie się do informacji genetycznej komórki gospodarza, dzięki czemu komórka jest zakażona na całe życie. Zakażenie może być uśpione, bez wytwarzania nowego wirusa, lub aktywne, z ciągłym wytwarzaniem nowego wirusa
HIV zakaża komórki odpornościowe, które mają na swojej powierzchni białko określane jako CD4. Niektóre komórki CD4 zakażone HIV umierają, ale inne pozostają w organizmie, przygotowane do walki z kolejnym zakażeniem w późniejszym czasie. Kiedy osoba zakażona HIV napotyka nową infekcję, taką jak grypa, lub zainfekowany uraz, zakażona HIV komórka CD4 reaguje jak niezawodny członek układu odpornościowego. Staje się ona aktywna, namnaża się i jako efekt uboczny, zanim umrze, wytwarza nowe cząsteczki HIV. Te nowe cząsteczki HIV zakażają następnie nowe komórki CD4, co powoduje powtórzenie cyklu. Ponieważ każdego dnia powstają miliardy nowych komórek odpornościowych, zazwyczaj potrzeba kilku lat, aby osoba zakażona HIV straciła wystarczającą liczbę komórek CD4, która będzie miała negatywny wpływ na jej zdolność do zwalczania innych infekcji. Gdy liczba komórek CD4 zostanie zmniejszona do punktu, w którym osoba nie może już skutecznie zwalczać nowych zakażeń, jej choroba HIV przechodzi w nowy stan określany jako zespół nabytego niedoboru odporności (AIDS).
Receptor wirusa: białko na powierzchni komórki, które umożliwia wirusowi związanie się, a następnie wejście do komórki w celu jej zainfekowania
Czy istnieje lekarstwo na zakażenie wirusem HIV?
Nie. Obecnie jest ono leczone lekami, które blokują określone etapy cyklu życiowego zakażenia HIV w komórkach CD4, ale ponieważ niektóre komórki CD4 żyją przez dziesięciolecia i nie są zabijane przez leki przeciwko HIV, ich potencjał do aktywacji, namnażania i tworzenia nowych cząstek wirusa utrzymuje się przez dziesięciolecia. Długie życie komórek odpornościowych jest ważne dla pamięci choroby, tzn. jest to powód, dla którego dorośli nie chorują na choroby wieku dziecięcego, takie jak ospa wietrzna, i powód, dla którego szczepienia są skuteczne przeciwko chorobom, takim jak polio, przez wiele dziesięcioleci.
Układ odpornościowy: zbiór komórek, które odpowiadają na infekcje i obce komórki najeźdźców oraz eliminują je
Czy komórki macierzyste mogą leczyć chorobę HIV?
Ponad 50 lat temu opracowano metody leczenia niektórych chorób układu odpornościowego, które są oryginalnymi terapiami z wykorzystaniem komórek macierzystych. Zabiegi te polegają na niszczeniu wszystkich chorych komórek odpornościowych, takich jak białaczki, za pomocą radioterapii i leków przeciwnowotworowych. (6,7,8). Po zniszczeniu chorego układu odpornościowego, jest on zastępowany przez przeszczepienie nowych komórek odpornościowych ze szpiku kostnego zdrowego dawcy.
Przeszczep szpiku kostnego: przeniesienie zdrowych komórek macierzystych szpiku kostnego od dawcy do biorcy, którego własny układ odpornościowy został zniszczony
Stało się to obecnie rutynowym sposobem leczenia wielu nowotworów i chorób krwi(1). Na początku pandemii HIV uznano, że przeszczepy szpiku kostnego mogą leczyć chorobę HIV. Jednak na drodze tego podejścia terapeutycznego stanęły przeszkody:
Po pierwsze, wszystkie zakażone HIV komórki CD4 biorcy muszą zostać zniszczone przed przeszczepem. Jeśli nie, komórki szpiku kostnego dawcy zostaną zakażone wirusem HIV, a przeszczep będzie na nic. Ponieważ nie wszystkie komórki CD4 w całym organizmie są niszczone przez promieniowanie i leki, zaobserwowano infekcję przeszczepionego szpiku kostnego (2). Ponieważ szpik kostny jest ograniczony w dostawach, społeczność medyczna była niechętna „marnowaniu” cennego szpiku kostnego na infekcje wirusem HIV.
Po drugie, przeszczepiony szpik kostny musi być idealnie dopasowany do komórek biorcy, lub nowy układ odpornościowy zaatakuje je jako „obce”, prowadząc do zagrażającego życiu stanu znanego jako „choroba przeszczep przeciwko gospodarzowi” (patrz: Komórki macierzyste specyficzne dla pacjenta). Ponieważ niewiele jest idealnych dopasowań, biorcy szpiku kostnego są zazwyczaj leczeni lekami hamującymi układ odpornościowy. Ponieważ supresja immunologiczna u osób zakażonych HIV prowadzi do AIDS, możliwość ta jeszcze bardziej ograniczyła entuzjazm dla leczenia przeszczepem szpiku kostnego choroby HIV i ograniczyła je do tych osób, u których rozwinął się również nowotwór, do którego przeszczep szpiku kostnego był potrzebny.
Co ważne, dowód na skuteczność przeszczepu szpiku kostnego w chorobie HIV został przedstawiony w 2009 roku w New England Journal of Medicine(3). Zespół niemieckich lekarzy leczących zakażonego HIV mężczyznę z nowotworem, chłoniakiem, poprzez przeszczep szpiku kostnego, był w stanie wykorzystać szpik kostny pochodzący od osobnika, który był naturalnie odporny na zakażenie HIV. W przeciwieństwie do wcześniejszych doniesień, nowe komórki szpiku kostnego nie uległy zakażeniu HIV.
Czym jest naturalna odporność na zakażenie HIV?
Badania osób rutynowo narażonych na zakażenie HIV, które jednak nie uległy zakażeniu, ujawniły, że oprócz komórek posiadających białko CD4, skuteczna infekcja wymaga również jednego z dwóch dodatkowych białek receptorowych, określanych jako CXCR4 i CCR5. CXCR4 jest białkiem ulegającym ekspresji na powierzchni wielu komórek, nie tylko komórek CD4, natomiast CCR5 ulega ekspresji rzadziej. Osoby genetycznie pozbawione CCR5 wyglądają normalnie i wykazują niezwykłą odporność na infekcję HIV. Dawca szpiku kostnego dla niemieckiego pacjenta był genetycznie pozbawiony białka CCR5.
Jak komórki macierzyste mogą zapewnić terapię choroby HIV?
Raport proof-of-concept z Niemiec wspiera wartość przeszczepu szpiku kostnego dla choroby HIV. Nowe osiągnięcia w nauce o komórkach macierzystych otwierają nowe drogi do rozwiązania głównych barier dla tego podejścia terapeutycznego.
Po pierwsze, możliwość pozyskiwania komórek macierzystych specyficznych dla pacjenta (patrz: Komórki macierzyste specyficzne dla pacjenta) wyeliminuje marnowanie cennego szpiku kostnego.
Po drugie, metody laboratoryjne rozwijania komórek macierzystych szpiku kostnego z komórek macierzystych specyficznych dla pacjenta znacznie się rozwinęły w ciągu ostatnich dwóch lat (4), eliminując w ten sposób potrzebę dobrego dopasowania tkankowego z banku szpiku kostnego.
Po trzecie, laboratoryjne metody wyciszania genów w komórkach macierzystych również znacznie się rozwinęły w ciągu ostatnich dwóch lat(5).
Patrząc na to wszystko razem, jest teraz możliwe wyprowadzenie komórek macierzystych specyficznych dla pacjenta od osób zakażonych HIV, zróżnicowanie ich w komórki macierzyste szpiku kostnego i znokautowanie białka CCR5, czyniąc je odpornymi na zakażenie HIV. Takie źródło komórek byłoby wówczas dostępne do przeszczepienia osobie zakażonej HIV, która może, ale nie musi, być przygotowana poprzez poddanie się radioterapii i leczeniu farmakologicznemu w celu całkowitej ablacji wszystkich komórek zakażonych HIV. Ponieważ nowe komórki nie będą podatne na infekcję HIV, może być możliwe, że z czasem po prostu zastąpią komórki zainfekowane HIV.
Jaki jest harmonogram rozwoju specyficznych dla pacjenta, CCR5 negatywnych, komórek macierzystych szpiku kostnego do leczenia HIV?
Nauka specyficznych dla pacjenta komórek macierzystych porusza się szybko. Do połowy 2011 roku, najlepsze źródła mogą być w zasięgu ręki. W tym samym czasie zostaną również określone najbardziej efektywne metody laboratoryjne przekształcania komórek macierzystych w komórki macierzyste szpiku kostnego. W związku z tym, rok 2012 jest realistycznym terminem dla rozwoju niezawodnych metod pozyskiwania komórek macierzystych szpiku kostnego specyficznych dla pacjenta.
Laboratoryjne metody znokautowania białka CCR5 mogą również zająć od 2 do 3 lat. Kilka podejść jest obecnie badanych(5).
Odkąd negatywne CCR5, specyficzne dla pacjenta komórki macierzyste szpiku kostnego są w zasięgu ręki, prawdopodobnie do 2013 roku, muszą być badane pod kątem bezpieczeństwa i skuteczności. To może być najdłuższa faza pracy, ponieważ konieczne będzie udowodnienie długoterminowego przeżycia i braku negatywnych skutków ubocznych w modelu zwierzęcym. Ostrożny szacunek dla tej fazy to 3 do 5 lat.
Więc, jeśli finansowanie będzie dostępne, w ciągu 5 do 8 lat będzie wiadomo, czy specyficzne dla pacjenta, CCR5-negatywne, komórki macierzyste szpiku kostnego są użytecznym narzędziem w walce z chorobą HIV.
Czy koszty będą zbyt wysokie?
Dopóki nie będzie znana wydajność, z jaką można uzyskać specyficzne dla pacjenta, CCR5-ujemne, komórki macierzyste szpiku kostnego, nie będzie możliwe przewidzenie całkowitych kosztów za leczenie.
Jednakże, biorąc pod uwagę obecny koszt 25 000 do 50 000 USD rocznie na pacjenta za monitorowanie i leczenie choroby HIV w USA, jest wysoce prawdopodobne, że terapia komórkami macierzystymi może być znacznie mniej kosztowna.
Bedford Research scientists will begin the patient-specific Testis Stem Cell Project in 2010, as soon as funding is available.
- Kiessling AA and Anderson SC 2007 Human Embryonic Stem Cells, Jones and Bartlett plublishers
- Krishnan A,Zaia J, and Forman SJ 2003. Should HIV-positive patients with lymphoma be offered stem cell transplants? Bone Marrow Transplantation 32: 741-748
- Hutter G, Nowak D, Mosner M, Ganepola S, Mubig A, Allers K, Schneider T, Hofmann J, Kucherer C, Blau O, Blau I, Hofmann W, Thiel E 2009. New England Journal of Medicine 360: 693-698.
- Goodrich A, Ersek A, Varain N, Groza D, Cenariu M, Thain D, Almeida-Porada G, Porada C, Zanjani E 2010. In vivo generation of b-cell-like cells from CD34+ cells differentiated from human embryonic stem cells. Experimental Hematology 38: 516-525.
- Shimizu S, Hong P, Arumugam B, Pokomo Ll, Boyer J, Koizumi N, Kittipongdaja P, Chen A, Bristol G, Ballic Z, Zack J, Yang O, Chen I, Lee B, An D 2010. A highly efficient short hairpin RNA potently down-regulates CCR5 expression in systemic lymphoid organs in the hu-BLT mouse model. Blood 115: 1534-1544.
.