Histone Modification | EpiGentek
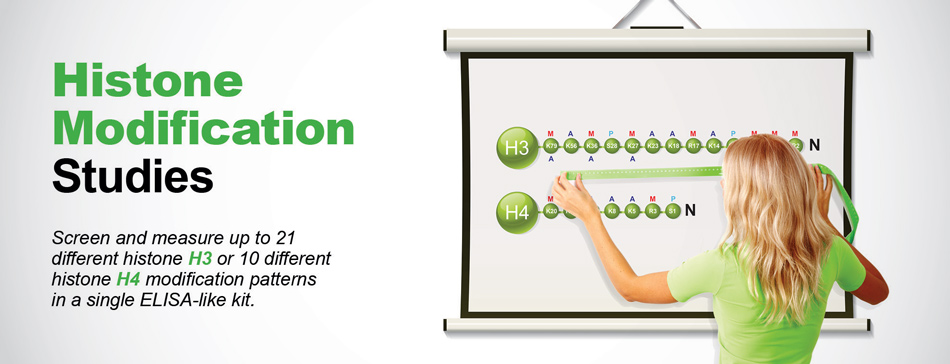
Complete Solutions forHistone Modification Studies
Histony są podstawowymi białkowymi składnikami eukariotycznej chromatyny i odgrywają rolę w regulacji genów. Histony H3 i H4 mają ogony wystające z nukleosomu, które mogą być modyfikowane potranslacyjnie w celu zmiany oddziaływań histonów z DNA i białkami jądrowymi, co prowadzi do zmian epigenetycznych regulujących wiele procesów prawidłowych i związanych z chorobami. Firma Epigentek oferuje kompletną serię zestawów do ilościowego oznaczania metylacji, acetylacji i fosforylacji histonów H3 we wszystkich miejscach (patrz nasza tabela informacyjna dotycząca modyfikacji histonów).
Oferujemy najbardziej wszechstronny wybór produktów do badań nad modyfikacją histonów, aby pokryć każdy etap przebiegu eksperymentu, od początku do końca.
Łatwe rozpoczęcie pracy z testami H3 & H4 Multiplex Assays
Wykryj i zmierz do 21 różnych wzorów modyfikacji histonu H3 lub 10 różnych wzorów modyfikacji histonu H4 w jednym zestawie podobnym do testu ELISA.
- EpiQuik Histone H3 Modification Multiplex Assay Kit (Colorimetric)
Wykryj i zmierz jednocześnie 21 różnych, dobrze scharakteryzowanych modyfikacji histonu H3 w ciągu zaledwie 2,5 godziny. - EpiQuik Histone H4 Modification Multiplex Assay Kit (Colorimetric) W prostej procedurze trwającej 2 godziny i 30 minut, wykryj i oznacz ilościowo niemal wszystkie modyfikacje histonu H4 (10 różnych typów) jednocześnie.
- EpiQuik Circulating Modified Histone H3 Multiplex Assay Kit (Colorimetric)
Symultanicznie wykrywaj i kwantyfikuj do 22 różnych, dobrze scharakteryzowanych wzorów zmodyfikowanego histonu H3 bezpośrednio z osocza/surowicy w ciągu zaledwie 2,5 godziny.
Przeciwciała metylacji histonów
Metylacja lizyny histonów, metylacja argininy histonów i inne przeciwciała metylacji histonów.
Przeciwciała acetylacji histonów
Acetylacja lizyny histonów, HDAC i inne przeciwciała acetylacji histonów.
Metylacja histonów
Metylacja histonów
Mechanizm znany jako metylacja histonów jest potranslacyjną modyfikacją epigenetyczną, która obejmuje przeniesienie grup metylowych do białek histonowych za pośrednictwem metylotransferaz histonowych (HMT). Grupy metylowe są dodawane do „ogonów”, które wystają z białek histonowych, co jest najczęstszym miejscem modyfikacji potranslacyjnych, zwłaszcza ogonów N-końcowych. Alternatywnie, demetylacja histonów polega na usuwaniu grup metylowych z ogonów histonów katalizowanym przez demetylazy histonowe (HDMs). Metylacja i demetylacja histonów są modyfikacjami epigenetycznymi, które mają moc zmniejszania lub zwiększania ekspresji genów, szczególnie w wyniku zmiany struktury chromatyny.
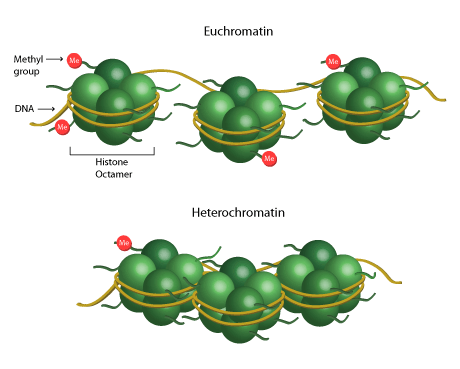
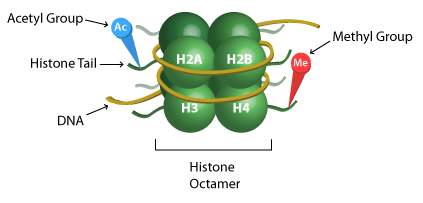
Histon jest białkiem, które pomaga w tworzeniu struktury chromatyny, która składa się z oktamerów białek owiniętych DNA. Te oktamery składają się z duplikatów czterech histonów rdzeniowych (H2A, H2B, H3 i H4). Ta jednostka chromatyny jest powszechnie znana jako nukleosom. Represja lub aktywacja transkrypcji może zachodzić w wyniku metylacji lub demetylacji histonów w wyniku rozluźnienia lub ograniczenia struktury chromatyny. Heterochromatyna i euchromatyna odnoszą się do struktury chromatyny, która składa się odpowiednio z ciasno lub luźno upakowanego DNA wokół histonów. Heterochromatyna jest nieaktywna transkrypcyjnie, podczas gdy euchromatyna jest aktywna transkrypcyjnie.
Gdzie i ile grup metylowych jest dodanych do histonów w dużej mierze decyduje o tym, czy chromatyna jest dostępna dla transkrypcji czy nie. Reszty ogonowe – lizyna (K) i arginina (R) – mogą być metylowane w różnym stopniu i z różnym skutkiem. Na przykład, gdy histon H4 jest monometylowany na lizynie 20 (H4K20me1), ta powszechna modyfikacja histonów powoduje kurczenie się chromatyny. Ograniczenie struktury chromatyny uniemożliwia transkrypcję i zmniejsza ekspresję genów. Alternatywnie, monometylacja histonu H3 na argininie 17 (H3R17me1) prowadzi do aktywacji transkrypcji.

Metylacja lizyny jest zaangażowana zarówno w aktywację transkrypcji (H3K4, K36, K79), jak i wyciszanie (H3K9, K27, H4K20), a badanie efektów tych modyfikacji histonów pozwoli badaczom lepiej zrozumieć, jak przeniesienie lub usunięcie różnych ilości grup metylowych do lub z różnych reszt lizyny lub argininy wpłynie na ekspresję genów. Kod histonu” próbuje opisać sposób, w jaki modyfikacje histonu działają razem w różnych kombinacjach, aby kontrolować pewne procesy komórkowe.
Poprzez pomiar modyfikacji histonu, naukowcy mogą odkryć nowy epigenetyczny wgląd w procesy komórkowe i stany chorobowe. Nieprawidłowe modyfikacje, na przykład, zostały podłączone do wielu różnych chorób, począwszy od raka do zaburzeń autoimmunologicznych i chorób zapalnych i neurologicznych. Oprócz lepszego zrozumienia epigenetycznych podstaw patologicznego procesu chorobowego, wykrywanie modyfikacji histonów może również pomóc w opracowaniu leków ukierunkowanych na modyfikacje histonów.
Z zestawem EpiQuik Histone H3 Modification Multiplex Assay Kit można uzyskać ogólny obraz statusu modyfikacji histonów w próbce. Ta metoda podobna do ELISA wymaga jedynie standardowego czytnika mikropłytek. Oszczędność czasu i pieniędzy dzięki jednoczesnemu pomiarowi 21 różnych modyfikacji histonu H3, które obejmują wszystkie najważniejsze i dobrze scharakteryzowane wzorce:
| H3K4me1 | H3K4me2 | H3K4me3 | H3K9me1 | H3K9me2 | H3K9me3 | |
| H3K27me1 | H3K27me2 | H3K27me3 | H3K36me1 | H3K36me2 | H3K36me3 | |
| H3K79me1 | H3K79me2 | H3K79me2 | H3K79me3 | H3K9ac | H3K14ac | H3K18ac |
| H3K56ac | H3ser10P | H3ser28P | Ogółem H3 | . |
Zestaw EpiQuik Histone H4 Modification Multiplex Assay Kit pozwala na pomiar 10 różnych modyfikacji histonu H4 w prosty sposób, ELISA, który obejmuje prawie wszystkie miejsca modyfikacji histonu H4:
| H4K5ac | H4K8ac | H4K12ac | H4K16ac | H4R3me2a | H4R3me2s | |
| H4K20me1 | H4K20me2 | H4K20me3 | H4K20me3 | H4ser1 | Total H4 |
Acetylacja histonów
Acetylacja histonów jest modyfikacją epigenetyczną charakteryzującą się dodaniem grupy acetylowej do białek histonowych, w szczególności do reszt lizynowych w obrębie N-końcowego ogona. Ta modyfikacja histonów jest katalizowana przez enzymy znane jako acetylotransferazy histonowe (HAT). Dwa różne typy HAT – cytoplazmatyczne i jądrowe – są określane na podstawie lokalizacji wewnątrzkomórkowej i specyficzności histonów. Alternatywnie, deacetylazy histonowe (HDAC) działają w celu usunięcia grup acetylowych w procesie znanym jako deacetylacja histonów.
Podobnie do innych modyfikacji histonów, acetylacja/deacetylacja histonów wpływa na strukturę chromatyny i, z kolei, na ekspresję genów, poprzez uczynienie DNA bardziej lub mniej dostępnym dla transkrypcji. Acetylacja reszt lizyny prowadzi do aktywnej transkrypcyjnie struktury chromatyny (euchromatyny), a deacetylacja prowadzi do nieaktywnej, skondensowanej struktury chromatyny (heterochromatyny).
Istnieją cztery główne klasy HDAC: Klasa I, Klasa II, Klasa III i Klasa IV. HDAC1, HDAC2, HDAC3 i HDAC8 należą do klasy I. HDAC4, HDAC5, HDAC6, HDAC7, HDAC9 i HDAC10 należą do klasy II. Siedem sirtuin, w tym SIRT1 do SIRT7, należy do klasy III. Wreszcie klasa IV składa się tylko z HDAC11. Klasyfikacje te są oparte na ich homologii do białek drożdżowych.
Badając acetylację i deacetylację histonów, naukowcy mogą uzyskać lepszy wgląd w „kod histonów”. Badania te mogą również przyczynić się do rozwoju leków ukierunkowanych na HDAC. Na przykład, inhibitory deacetylazy histonowej (HDACi) są często stosowane jako stabilizatory nastroju i leki przeciwpadaczkowe, a ostatnio są stosowane w leczeniu nowotworów, chorób neurodegeneracyjnych i zapalnych. Co ciekawe, inhibitory HDAC wykazują specyficzność w stosunku do komórek nowotworowych, co może wyjaśniać ich szerokie zastosowanie jako leków przeciwnowotworowych.
Zobacz acetylację histonów&Zestawy do deacetylacji
Fosforylacja histonów
Fosforylacja histonów jest modyfikacją potranslacyjną, która wpływa na reszty serynowe, treoninowe i tyrozynowe. Polega ona na dodaniu grupy fosforylowej do ogonów histonów, co może odgrywać rolę w przebudowie chromatyny. Możliwe jest, aby wszystkie cztery nukleosomalne ogony histonowe były fosforylowane. Jedną z najlepiej poznanych funkcji fosforylacji histonów jest odpowiedź komórki na uszkodzenia DNA. Chociaż odkryto liczne miejsca fosforylacji, nowe miejsca są odkrywane w trwających badaniach epigenetycznych.
Zobacz zestawy do fosforylacji histonów
.