Diagnostyka i leczenie zespołu Sjögrena
Tło: Zespół Sjögrena jest jedną z częstszych zapalnych chorób reumatologicznych, z częstością występowania w Niemczech wynoszącą co najmniej 0,4%.
Metody: Niniejszy przegląd opiera się na odpowiednich artykułach wyszukanych przez selektywne wyszukiwanie w PubMed. Szczególną uwagę zwrócono na zaktualizowane kryteria klasyfikacji i aktualne zalecenia dotyczące leczenia.
Wyniki: Zespół Sjögrena ma bardzo różnorodną prezentację, od miejscowego zajęcia gruczołów zewnątrzwydzielniczych z keratoconjunctivitis sicca i kserostomią (wiodące objawy choroby) do ogólnoustrojowego, pozagruczołowego zajęcia wielu narządów. Zmęczenie również znacznie pogarsza jakość życia pacjentów. W badaniach serologicznych stwierdza się autoprzeciwciała przeciwjądrowe (anty-Ro/SSA i anty-La/SSB) oraz czynniki reumatoidalne. Histologicznym wyróżnikiem choroby jest ogniskowy naciek limfocytarny w normalnie wyglądających gruczołowych acini. Choroba znacznie zwiększa również ryzyko wystąpienia chłoniaka nieziarniczego z komórek B, który powstaje u około 5% pacjentów. Pierwotny zespół Sjögrena (pSS) różni się od postaci wtórnej (sSS), która pojawia się w przebiegu innej choroby autoimmunologicznej, zwłaszcza tocznia rumieniowatego układowego (15-36%), reumatoidalnego zapalenia stawów (20-32%) oraz ograniczonej lub postępującej twardziny układowej (11-24%). Terapia modyfikująca przebieg choroby jest zarezerwowana dla pacjentów z zajęciem układowym; istnieją ograniczone dowody na jej skuteczność. Ze względu na złożoność tej choroby niektóre z jej objawów klinicznych mogą wymagać leczenia interdyscyplinarnego.
Wnioski: Główne względy w interdyscyplinarnej opiece nad pacjentami z chorobą Sjögrena to działania mające na celu poprawę jakości życia, leczenie farmakologiczne i niefarmakologiczne w celu utrzymania aktywności choroby pod kontrolą oraz zarządzanie ryzykiem wystąpienia chłoniaka. Przyszłe podejścia terapeutyczne muszą uwzględniać heterogenność choroby.
![]()
![]()
Zespół Sjögrena jest przewlekłą zapalną chorobą autoimmunologiczną o nieznanym pochodzeniu, atakującą w szczególności gruczoły łzowe i ślinowe. Charakterystyczną cechą choroby, która może przebiegać również z różnymi manifestacjami narządowymi, są objawy sicca. Ze względu na dużą różnorodność oznak i objawów, pacjenci z zespołem Sjögrena podczas pierwszej konsultacji mogą spotkać się z różnymi lekarzami, w tym z lekarzami rodzinnymi, okulistami, laryngologami i stomatologami. Dlatego tak ważne jest, aby lekarze różnych specjalności byli poinformowani o aktualnych aspektach objawów klinicznych choroby, zmienionych kryteriach klasyfikacyjnych i aktualnych możliwościach leczenia.
Pierwotny zespół Sjögrena (pSS) odróżnia się od wtórnego zespołu Sjögrena (sSS), który występuje jako część innych chorób autoimmunologicznych. sSS współistnieje zwłaszcza z toczniem rumieniowatym układowym (15-36%), reumatoidalnym zapaleniem stawów (20-32%) oraz ograniczoną i postępującą twardziną układową (11-24%), rzadziej ze stwardnieniem rozsianym oraz autoimmunologicznym zapaleniem wątroby i tarczycy (1). Termin „wtórny” nie opisuje tu chronologicznej kolejności ujawniania się choroby: Choroba podstawowa może początkowo przebiegać z objawami sicca, a dopiero później ujawnić się w przebiegu choroby. Ustalenie rozpoznania jest często trudne u pacjentów z nakładającymi się jednostkami chorobowymi. Biorąc pod uwagę odmienny przebieg choroby (w tym rokowanie), ważne jest różnicowanie pomiędzy pierwotną i wtórną postacią zespołu Sjögrena.
Epidemiologia
Niejednorodność dostępnych danych dotyczących częstości występowania i zapadalności na zespół Sjögrena wynika z różnic w projektowaniu badań i kryteriach klasyfikacji. Globalna częstość występowania obliczona dla rzadszego pSS wynosi 61 na 100 000 mieszkańców, przy czym najwyższą częstość występowania odnotowuje się w Europie (2). Kobiety chorują na zespół Sjögrena znacznie częściej niż mężczyźni; różnica między płciami waha się od 9:1 do 19:1. Średni wiek w momencie pierwszego rozpoznania pSS wynosi 56 lat, przy czym szczyt zachorowań przypada między 20. a 40. rokiem życia. Jednak pierwsze objawy mogą wystąpić na wiele lat przed rozpoznaniem. Jak dotąd, brak jest wiarygodnych danych epidemiologicznych dla Niemiec. Przyjmuje się, że ogólna częstość występowania zespołu Sjögrena, w tym częściej występującej wtórnej postaci choroby, wynosi co najmniej 0,4% (3).
Objawy kliniczne
Według największej opublikowanej dotychczas kohorty, objawy sicca są najczęstszą manifestacją zespołu Sjögrena, występującą do 98% przypadków (4). Pacjenci z keratoconjunctivitis sicca (KCS) skarżą się na uczucie ciała obcego, pieczenie lub bolesność oczu oraz zwiększoną wrażliwość na światło. Wyraźna kserostomia jako objaw stomatitis sicca objawia się klinicznie jako trudności w mówieniu przez dłuższy czas oraz podczas żucia lub przeżuwania suchego pokarmu. W porównaniu z populacją ogólną, częstość występowania próchnicy i wczesnej utraty zębów jest około dwukrotnie wyższa u pacjentów z zespołem Sjögrena, a jakość życia związana ze zdrowiem jamy ustnej jest u nich znacznie obniżona. Nawracające infekcje jamy ustnej wywołane przez Candida albicans występują 10 razy częściej niż w populacji ogólnej (5). Z drugiej strony, objawy sicca są powszechnie zgłaszane wraz z postępującym wiekiem i polifarmacją: Około 5% do 35% populacji ogólnej cierpi z powodu suchości oczu (6), a około 20% pacjentów stomatologicznych doświadcza suchości w jamie ustnej (7). W związku z tym w interpretacji tych dolegliwości kluczowe znaczenie ma zebranie dokładnego wywiadu, z uwzględnieniem przyjmowanych leków, oraz przeprowadzenie badania fizykalnego, a następnie wykonanie specjalnych testów czynnościowych. Tabela 1 zawiera listę rozpoznań różnicowych dla dolegliwości gruczołowych. Ponadto należy zwrócić uwagę na inne objawy sicca, takie jak suchy kaszel w tracheobronchitis sicca lub objawy sicca w obrębie nosogardła lub dróg rodnych, objawiające się zwiększoną podatnością na infekcje lub dyspareunią.
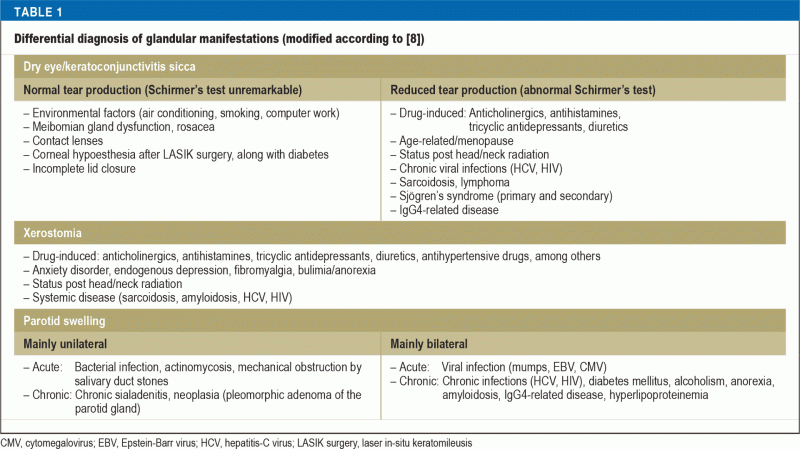
Do 34% pacjentów z zespołem Sjögrena zgłasza epizodyczny lub przewlekły, zwykle obustronny obrzęk ślinianek przyusznych (9). W tym przypadku istotne jest wykluczenie złośliwego chłoniaka nieziarniczego (NHL) z linii komórek B, który występuje u około 5% pacjentów z pSS (10), u których ryzyko rozwoju NHL jest znacznie zwiększone w porównaniu z populacją ogólną (współczynnik ryzyka: 13,7). Kluczowymi czynnikami predykcyjnymi rozwoju NHL są: niski poziom dopełniacza (RR: 8,3), krioglobulinemia (RR: 6,8), limfadenopatia (RR: 3,7), histologiczne stwierdzenie ektopowych struktur przypominających ośrodki zarodkowe, stały obrzęk ślinianki przyusznej i zapalenie naczyń skóry (10, 11). Pacjenci ci należą do grupy wysokiego ryzyka i wymagają monitorowania w krótszych odstępach czasu oraz, w razie potrzeby, dalszych badań diagnostycznych, takich jak radiografia klatki piersiowej i USG jamy brzusznej; nie ma jednak aktualnych zaleceń dotyczących badań przesiewowych w kierunku chłoniaków.
Najczęstszymi objawami pozagruczołowymi są bóle stawów i zwykle nieerozyjne zapalenie wielostawowe, które występują u około 50% pacjentów (9). Zajęcie płuc poza kompleksem sicca objawia się zwykle jako śródmiąższowa choroba płuc lub pęcherzykowe zapalenie oskrzeli, zwykle po wielu latach aktywności choroby (9-12%) (9, 12). U około 10% pacjentów występują zmiany skórne, w większości w postaci zapalenia naczyń z zajęciem małych i średnich naczyń kończyn dolnych. Ponadto mogą wystąpić inne, rzadziej spotykane manifestacje skórne, takie jak rumień obrączkowaty, pokrzywkowe zapalenie naczyń czy plamica hipergammaglobulinemiczna (9). Zajęcie nerek, które stwierdza się u około 5% pacjentów, jest zwykle związane ze zmianami tubulointerstitialnymi, które często przebiegają z kwasicą cewek nerkowych dystalnych (RTA typu 1) z hipokaliemiczną hipotonią mięśniową; kłębuszkowe zapalenie nerek jest rzadkie u pacjentów z pSS (9, 13).
Z kolei niespecyficzne dolegliwości, takie jak zmęczenie i rozproszony ból są trudniejsze do oceny. Jednak zmęczenie jest objawem najbardziej dokuczliwym dla pacjenta, determinującym częstość wizyt u lekarza, jakość życia, a także zdolność do pracy (16, e1). Należy wykluczyć inne stany chorobowe w diagnostyce różnicowej zmęczenia, takie jak niedoczynność tarczycy, niedokrwistość i zaburzenia snu, a także wziąć pod uwagę trudności w radzeniu sobie z chorobą.
Przeciwciała anty-Ro/SSA- i anty-La/SSB-dodatnie kobiety pragnące mieć dzieci wymagają specjalnego poradnictwa. Przeniesienie tych przeciwciał przez łożysko może spowodować zapalenie z następowym stwardnieniem węzła przedsionkowo-komorowego (AV), co niesie ze sobą ryzyko rozwoju wrodzonego bloku serca u płodu. W 80% przypadków dochodzi do całkowitego nieodwracalnego bloku serca, a w 20% śmiertelność płodu jest znacznie zwiększona (17). Cotygodniowe ultrasonograficzne monitorowanie rytmu serca płodu między 16 a 31 tygodniem ciąży jest niezbędne zarówno dla oceny prognostycznej, jak i postępowania.
Prognoza
Ogółem rokowanie w zespole Sjögrena jest korzystne. Oczekiwana długość życia pacjentów z pSS jest porównywalna z tą w populacji ogólnej (18). Jednak jakość życia pacjentów jest obniżona przez różnorodne manifestacje choroby. Głównymi przyczynami zgonów są choroby układu sercowo-naczyniowego, infekcje, guzy lite i chłoniaki. U pacjentów z sSS długość życia jest determinowana przez chorobę podstawową.
Patogeneza
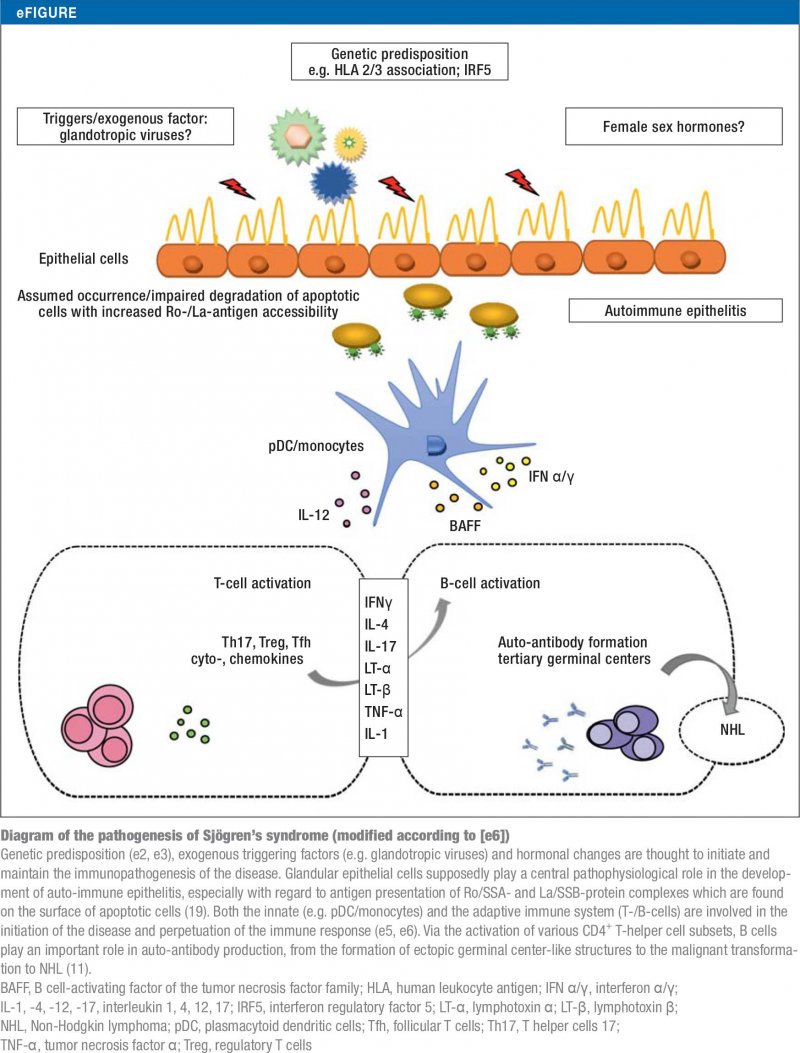
Jak w przypadku większości chorób autoimmunologicznych, etiologia zespołu Sjögrena nie jest jeszcze w pełni poznana (e2-e5, 19). Aktualne koncepcje jego patogenezy podsumowano na rycinie eFigure.
Kryteria klasyfikacyjne i ocena diagnostyczna
Od lat 70. ubiegłego wieku ustalono i oceniano różne kryteria klasyfikacyjne. Ostatnio istniejące kryteria amerykańskie z 2012 roku zostały po raz pierwszy włączone do aktualnej klasyfikacji przez główne towarzystwa, ACR (American College of Rheumatology) i EULAR (European League Against Rheumatism). U pacjentów, u których objawy sicca występowały przez co najmniej 3 miesiące, opierają się one na dalszych badaniach czynnościowych (np. test Schirmera) lub serologicznych (anty-Ro/SSA) i histologicznych (biopsja ślinianki wargowej). Spośród tych badań przeciwciała anty-Ro/SSA i nieprawidłowa biopsja ślinianki wargowej mają najwyższą swoistość, a co za tym idzie, są kryteriami o najwyższych wartościach. Minimalny wynik 4 punktów pozwala na zakwalifikowanie do zespołu Sjögrena (Ramka). Na rycinie przedstawiono algorytm diagnostyczny dla zespołu Sjögrena, oparty na zmienionych kryteriach klasyfikacji i różnych objawach choroby.


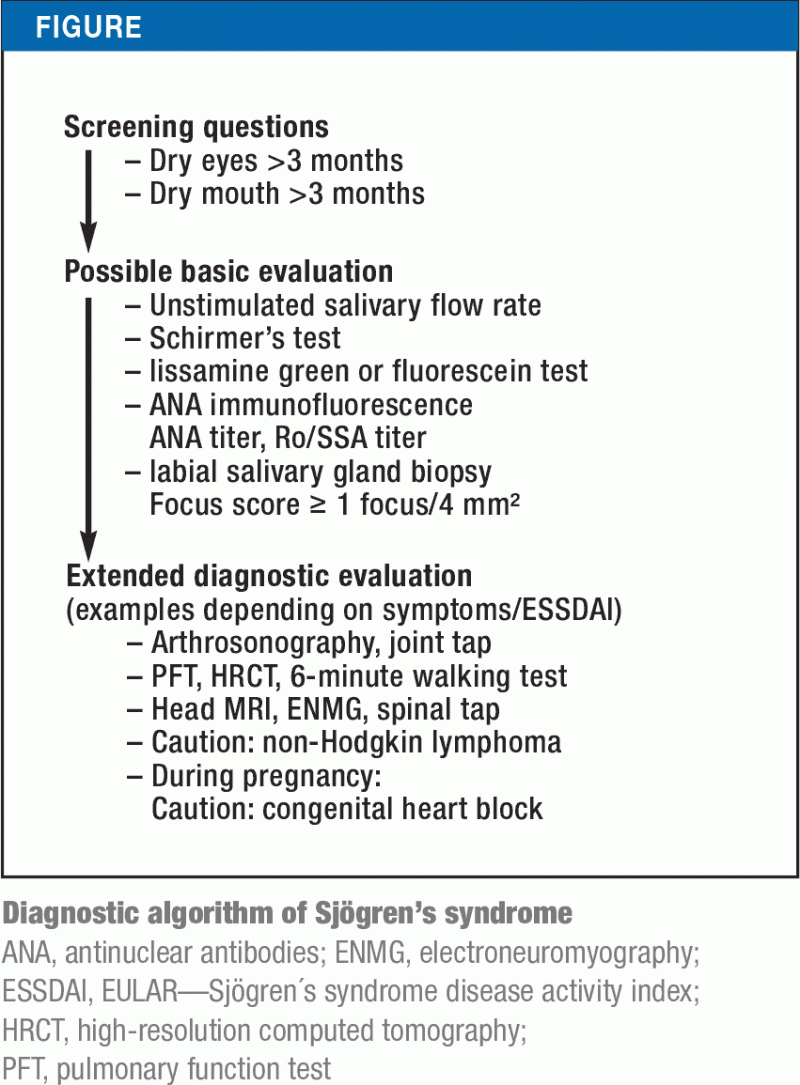

Testy obiektywne dla objawów sicca
Test Schirmera i test Saxona są łatwe do wykonania, ale ich wyniki nie korelują dobrze ze skargami pacjentów i powinny być oceniane w ogólnym kontekście. W tym przypadku kluczowa jest współpraca z oddziałem okulistycznym: Miejscowa aplikacja istotnych barwników (zieleń lissaminy lub fluoresceina) jest używana do uwidocznienia i oceny zmian rogówki i spojówki związanych z keratoconjunctivitis sicca. Bezpośredni pomiar ślinotoku jest złotym standardem diagnostycznym, ale w codziennej praktyce klinicznej jest to czasochłonne. Sialografia ślinianki przyusznej i scyntygrafia ślinianek nie mają wystarczającej swoistości. Ultrasonografia głównych gruczołów ślinowych, jako metoda nieinwazyjna, jest integralną częścią codziennej praktyki klinicznej. Jednak metoda ta nie została jeszcze wystarczająco zwalidowana, aby włączyć ją do kryteriów klasyfikacyjnych (21).
Badania laboratoryjne
Badanie immunofluorescencyjne na obecność przeciwciał przeciwjądrowych (ANA) ma duże znaczenie w diagnostyce chorób tkanki łącznej. Do 83% pacjentów z pSS wykazuje pozytywny wynik testu na obecność ANA (22). Jednakże, niskie miano (23). U pacjentów z dodatnim mianem ANA, drobnoplamisty wzór fluorescencji silnie wskazuje na obecność przeciwciał anty-Ro/SSA i/lub anty-La/SSB, co ujawnia się odpowiednio u około 40% do 75% i 23% do 52% pacjentów z pSS (24). Wraz z ostatnim wzrostem wartości diagnostycznej przypisywanej przeciwciałom anty-Ro/SSA w obecnym systemie klasyfikacji, można oczekiwać, że znacznie więcej nowo sklasyfikowanych pacjentów z zespołem Sjögrena będzie miało podwyższone poziomy przeciwciał w porównaniu z kohortami historycznymi. Dodatnie miana przeciwciał korelują z wczesnym początkiem choroby, bardziej intensywnym naciekaniem tkanek i częstszym występowaniem objawów pozagruczołowych. Jednakże pacjenci z innymi chorobami tkanki łącznej mogą również wykazywać dodatnie miana przeciwciał anty-Ro/SSA. W tym przypadku kontekst kliniczny ma kluczowe znaczenie, zwłaszcza dla różnicowania nakładających się jednostek chorobowych. Co ciekawe, serologiczne zjawiska autoimmunologiczne były wykrywane nawet do 20 lat przed pojawieniem się pierwszych oznak i objawów choroby (25). Inne nieprawidłowości serologiczne obejmują obecność czynników reumatoidalnych (60-75%), a także poliklonalną hipergammaglobulinemię jako oznakę zwiększonej aktywności komórek B.
Rozwój biomarkerów, dostarczających informacji prognostycznych i umożliwiających monitorowanie postępu choroby, osiągnął obecnie fazę tworzenia. Wzrost stężenia beta2-mikroglobuliny i wolnych łańcuchów lekkich immunoglobulin wiąże się ze zwiększonym ryzykiem chłoniaka (26). Siglec-1 pojawił się ostatnio jako nowy biomarker. Ten pośredni marker interferonu koreluje z wysokim poziomem aktywności choroby, jak również z manifestacjami pozagruczołowymi (27).
Histopatologia
Wykrycie histopatologiczne ogniskowych, zlokalizowanych okołoodbytniczo nacieków limfocytarnych w egzokrynnej tkance gruczołowej wraz z nieuszkodzonymi jednostkami acinarnymi jest patognomoniczne dla zespołu Sjögrena. Nacieki te składają się głównie z limfocytów T CD4+, z kilkoma dodatkowymi limfocytami T CD8+ i limfocytami B CD19+, komórkami plazmatycznymi i komórkami dendrytycznymi. W celu odróżnienia zespołu Sjögrena od innych jednostek chorobowych wymagana jest głęboka wiedza specjalistyczna zgodna z międzynarodowymi zaleceniami dotyczącymi interpretacji wyników badań histopatologicznych (28). Minimalna liczba 50 komórek monocytarnych/4 mm² została zdefiniowana jako wynik ogniska (FS) równy 1. Wynik ogniska ≥1 koreluje z fenotypowymi cechami zespołu Sjögrena.
Postępowanie
Pomimo ciągłego postępu w naszym rozumieniu mechanizmów zaangażowanych w patogenezę choroby, ukierunkowane leczenie zespołu Sjögrena nie jest obecnie dostępne. Leczenie jest ustalane indywidualnie w zależności od aktywności choroby oraz obecności i rozległości objawów pozagruczołowych. U pacjentów z sSS wskazania do leczenia opierają się na chorobie podstawowej. Ogólnie rzecz biorąc, leczenie powinno być prowadzone przez zespół interdyscyplinarny, obejmujący lekarzy rodzinnych, reumatologów, okulistów i specjalistów ETN, a także stomatologów. W zależności od zajętego narządu (narządów) i występujących objawów może być konieczna konsultacja innych specjalistów (ginekologów, pulmonologów, neurologów itp.). Terapia modyfikująca przebieg choroby jest zarezerwowana dla pacjentów z zajęciem pozagruczołowym. W celu pomiaru aktywności choroby ogólnoustrojowej opracowano i zwalidowano wskaźnik aktywności choroby zespołu Sjögrena EULAR (ESSDAI) (29, e7).
Zarządzanie objawami sicca
W przypadku większości pacjentów głównym celem terapii jest poprawa jakości życia poprzez leczenie objawów sicca i zmęczenia. Jednocześnie jest to bardzo trudne zadanie dla lekarzy, ponieważ możliwości leczenia oparte na dowodach naukowych są ograniczone, a większość metod terapeutycznych ma jedynie charakter objawowy (tab. 2). Ważną rolę odgrywa edukacja pacjentów, skupiająca się na przestrzeganiu codziennych zasad zachowania (30)- ukierunkowanych na czynniki środowiskowe (np. nawilżanie powietrza), profilaktykę (np. fluor w profilaktyce próchnicy, rzucenie palenia), unikanie czynników nasilających zmęczenie (np, higiena snu), jak również sprawności fizycznej (aerobowy trening wytrzymałościowy w celu zwalczania zmęczenia).
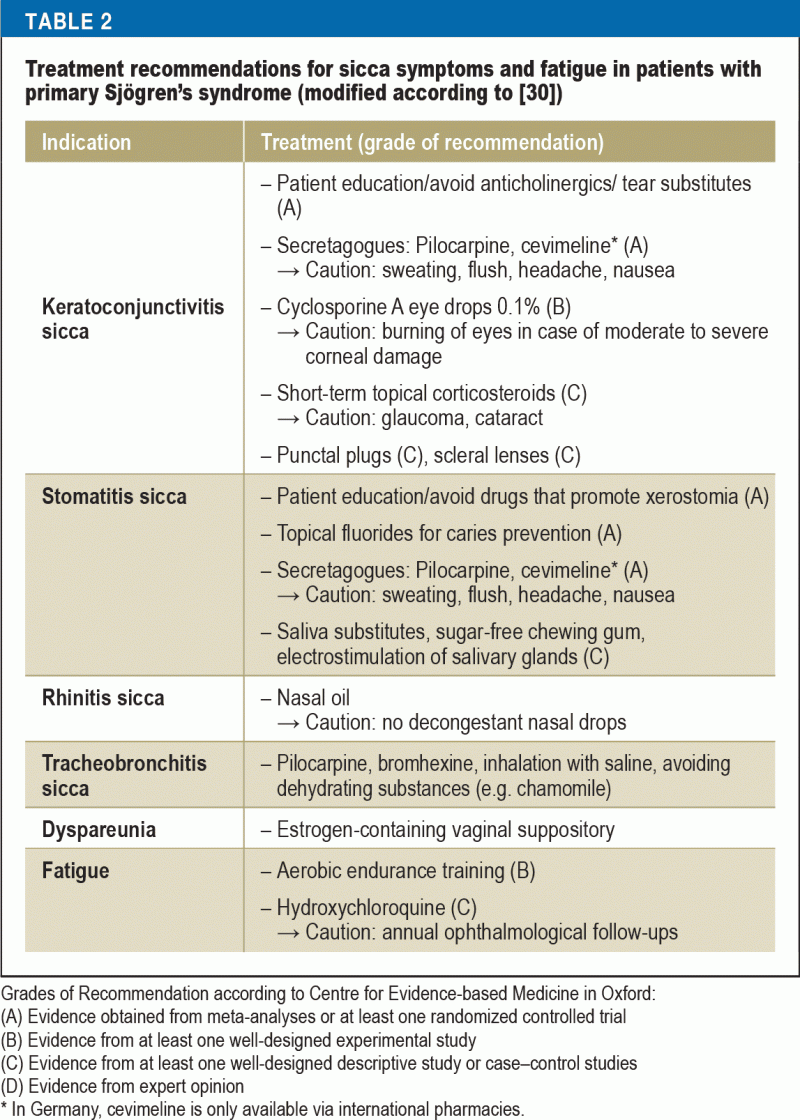
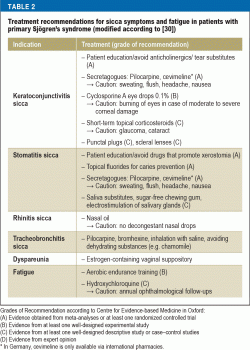
W leczeniu keratoconjunctivitis sicca dostępne są różne substytuty łez. Skład substytutów łez różni się w zależności od złożonej fizjologii trójwarstwowego przedokularowego filmu łzowego (warstwa lipidowa, warstwa wodnista i warstwa mucynowa). Ponieważ mechanizmy immunologiczne odgrywają główną rolę w patogenezie suchego oka, leczenie przeciwzapalne za pomocą kropli do oczu z cyklosporyną A zyskało duże znaczenie. Ich skuteczność została udowodniona w randomizowanych badaniach kontrolowanych (RCTs) i na podstawie danych z tych badań 0,1% kationowa emulsja cyklosporyny A otrzymała pozwolenie na dopuszczenie do obrotu od Europejskiej Agencji Leków (31). Dodatkowymi działaniami istotnie poprawiającymi jakość życia tych pacjentów jest stosowanie zatyczek punkcikowych oraz zakładanie bardzo dużych soczewek kontaktowych („scleral lenses”) z funkcją magazynowania wody (32). Dlatego niezbędna jest współpraca z okulistami.
Kserostomia jest leczona wspólnie przez stomatologów i otolaryngologów. Powierzchnia błony śluzowej jamy ustnej jest stosunkowo duża i różne struktury w jamie ustnej wymagają nawilżenia (język, zęby, dziąsła, błona śluzowa jamy ustnej). Ponadto, skład śliny zmienia się w zależności od funkcji i pory dnia. Optymalna kompensacja terapeutyczna złożonych funkcji śliny nie jest możliwa do osiągnięcia. Dwa przeglądy systematyczne dotyczące leczenia miejscowego/niefarmakologicznego prowadzą do wniosku, że chociaż można złagodzić objawy, to nie można zwiększyć przepływu śliny (33, 34). Opieka stomatologiczna nad pacjentami z kserostomią jest szczególnie trudna, ponieważ brak śliny zmniejsza tolerancję ruchomych uzupełnień protetycznych. Natomiast u pacjentów z zespołem Sjögrena dobre wyniki osiąga się dzięki leczeniu implantami stomatologicznymi (35).
Terapia modyfikująca przebieg choroby
Decyzja o intensyfikacji leczenia zależy od aktywności choroby i zajętego układu narządowego. Jednak nieliczne RCT oceniające stosowanie konwencjonalnych leków przeciwreumatycznych modyfikujących przebieg choroby (DMARDs) lub leków biologicznych u pacjentów z zespołem Sjögrena nie dostarczyły rozstrzygających dowodów potwierdzających ich skuteczność (30, 36). Decyzje dotyczące leczenia są często podejmowane na podstawie doświadczeń z pokrewnymi jednostkami chorobowymi, takimi jak toczeń rumieniowaty układowy. Analogicznie do innych chorób tkanki łącznej, hydroksychlorochina, środek o korzystnym profilu działań niepożądanych, jest lekiem z wyboru w przypadku różnych łagodnych i umiarkowanych objawów układowych, takich jak bóle stawów, zapalenie stawów, zmiany skórne i zmęczenie. Przykład hydroksychlorochiny zwraca uwagę na wyzwania związane z projektowaniem badań i wyborem pacjentów, którzy mogą odnieść korzyści z leczenia. W randomizowanym badaniu kontrolowanym nad pSS nie stwierdzono różnicy między hydroksychlorochiną a placebo w zakresie objawów sicca, bólu i zmęczenia po 24 tygodniach (37). Badanie to miało jednak istotne ograniczenia: aktywność choroby u tych pacjentów była niska, okres obserwacji krótki, a pierwszorzędowy punkt końcowy nie został zwalidowany. Aby zwiększyć wiarygodność przyszłych RCT badających tę heterogenną chorobę, konieczna jest rekrutacja reprezentatywnych grup pacjentów i wybór solidnych pierwotnych punktów końcowych.
W odniesieniu do zmęczenia, badanie pilotażowe wykazało umiarkowaną skuteczność rytuksymabu (38). Niestety, nie zostało to potwierdzone w dużym RCT przeprowadzonym kilka lat później (39).
Zalecenia dotyczące leczenia w odniesieniu do immunosupresji różnią się w zależności od zajęcia narządów (tab. 3). U chorych z ciężką manifestacją narządową udowodnioną skuteczność ma stosowanie metyloprednizolonu i cyklofosfamidu w dużych dawkach. W przypadku ciężkiego zapalenia naczyń, zwłaszcza z towarzyszącą krioglobulinemią, zalecanymi metodami leczenia są rytuksymab lub plazmafereza. U pacjentów z NHL leczenie dobiera się w zależności od podtypu i stadium zaawansowania zgodnie z aktualnymi wytycznymi dotyczącymi leczenia chorób hematoonkologicznych.
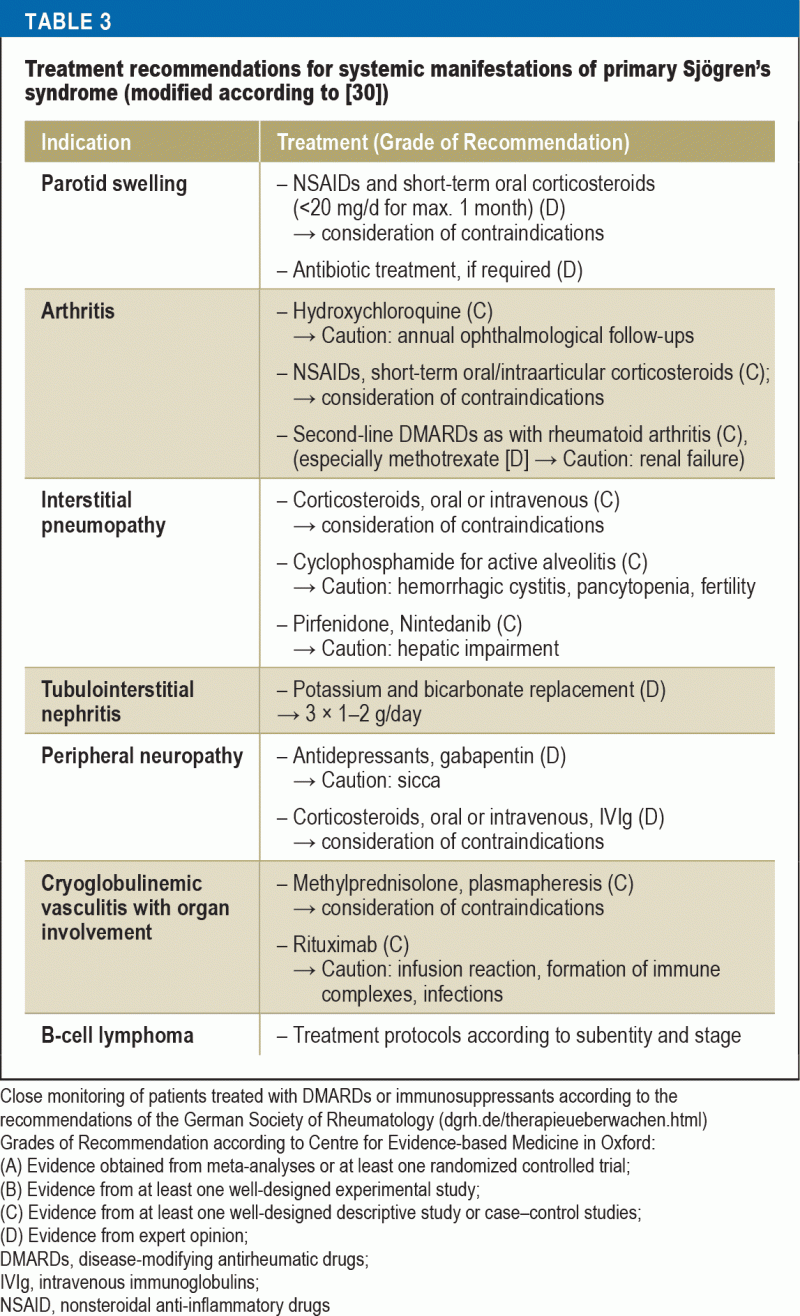
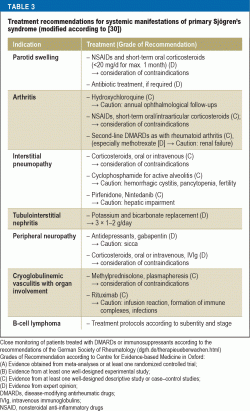
Zalecanym leczeniem dla kobiet w ciąży z zespołem Sjögrena i wysokim ryzykiem wrodzonego bloku serca jest hydroksychlorochina w celu zminimalizowania ryzyka; jednak zalecenie to jest oparte wyłącznie na dowodach z badań retrospektywnych (40).
Nowe metody leczenia, ukierunkowane na mechanizmy patofizjologiczne, są obecnie oceniane w RCT z użyciem zwalidowanych narzędzi (ESSDAI): modulacja nadaktywności komórek B (np, belimumab), antagonizowanie ko-stymulacji komórek T (np. abatacept), cytokin efektorowych (np. interleukina-6-receptor/tocilizumab; interferon α/anifrolumab), a także zapobieganie powstawaniu ektopowych struktur przypominających centra zarodkowe (np. blokada limfotoksyny-βR). Badania te stoją przed wyzwaniem wykazania skuteczności w odniesieniu do trzech zespołów objawów – bólu, zmęczenia i objawów pozagruczołowych.
Oświadczenie o konflikcie interesów
Prof. Dörner otrzymał honoraria za konsultacje od firm UCB, Novartis i Roche oraz wsparcie finansowe za prowadzenie badań klinicznych od firm UCB i Novartis.
Prof. Pleyer otrzymał honoraria za konsultacje i wykłady od firm Santen, Théa i Allergan.
Prof. Burmester otrzymał wsparcie finansowe na prowadzenie badań klinicznych od firm Novartis, UCB i Roche.
Dr Stefanski, dr Tomiak i prof. Dietrich deklarują brak konfliktu interesów.
Manuskrypt otrzymano 13 grudnia 2016 roku; wersja poprawiona zaakceptowana 14 marca 2017 roku
Tłumaczenie z oryginału niemieckiego przez Ralfa Thoene, MD.
Corresponding author
Dr n. med. Ana-Luisa Stefanski
Charite Universitatsmedizin Berlin
Rheumatologie und klinische Immunologie
Charitéplatz 1
10117 Berlin, Germany
[email protected]
Materiały uzupełniające
Dla eReferencji proszę odnieść się do:
www.aerzteblatt-international.de/ref2017
eFigure:
www.aerzteblatt-international.de/17m0354
.