Batterie plomb-acide : Fonctionnement, construction et chargement/déchargement
Presque tous les appareils portables et de poche consistent en une batterie. La batterie est un dispositif de stockage où l’énergie est stockée pour fournir de l’énergie chaque fois que nécessaire. Il existe différents types de batteries disponibles dans ce monde de l’électronique moderne, parmi eux la batterie plomb-acide est couramment utilisée pour l’alimentation en énergie élevée. Habituellement, les batteries plomb-acide sont plus grandes en taille avec une construction dure et lourde, elles peuvent stocker une grande quantité d’énergie et sont généralement utilisées dans les automobiles et les onduleurs.
Même après avoir obtenu la concurrence avec les batteries Li-ion, la demande de batteries plomb-acide augmente de jour en jour, car elles sont moins chères et faciles à manipuler par rapport aux batteries Li-ion. Selon certaines études de marché, le marché indien des batteries au plomb devrait croître à un taux de croissance annuel composé de plus de 9 % au cours de la période 2018-24. Ainsi, il a une énorme demande du marché dans l’automatisation, l’automobile et l’électronique grand public. Bien que la plupart des véhicules électriques viennent avec des batteries Lithion-ion, mais il y a encore beaucoup de deux roues électriques qui utilisent des batteries plomb-acide pour alimenter le véhicule.
Dans le tutoriel précédent, nous avons appris sur les batteries Lithium-ion, ici nous allons comprendre le Travail, la construction et les applications des batteries plomb-acide. Nous apprendrons également les cotes de charge/décharge, les exigences et la sécurité des batteries au plomb-acide.
Construction de la batterie au plomb-acide
Qu’est-ce qu’une batterie au plomb-acide ? Si nous cassons le nom Lead Acid battery, nous obtiendrons Lead, Acid, et Battery. Le plomb est un élément chimique (le symbole est Pb et le numéro atomique est 82). C’est un élément mou et malléable. Nous savons ce qu’est un acide : il peut donner un proton ou accepter une paire d’électrons lorsqu’il réagit. Ainsi, une batterie, qui se compose de Plomb et d’acide plumbique anhydre (parfois appelé à tort peroxyde de plomb), est appelée batterie plomb-acide.
Maintenant, quelle est la construction interne ?
Une batterie plomb-acide se compose des choses suivantes, nous pouvons le voir dans l’image ci-dessous:
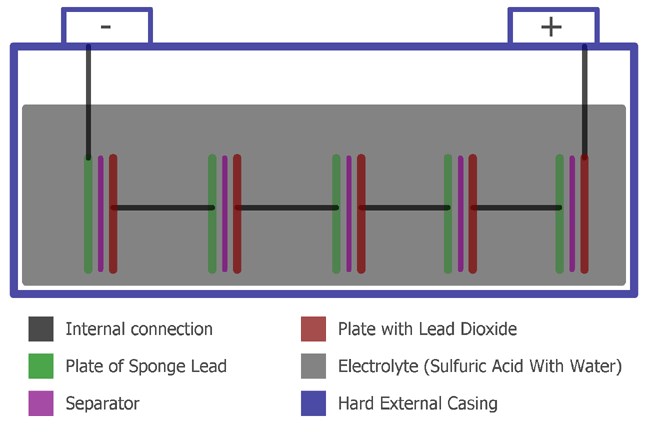
Une batterie plomb-acide se compose de plaques, d’un séparateur et d’un électrolyte, de plastique dur avec un boîtier en caoutchouc dur.
Dans les batteries, les plaques sont de deux types, positives et négatives. La positive est constituée de dioxyde de plomb et la négative est constituée de plomb éponge. Ces deux plaques sont séparées à l’aide d’un séparateur qui est un matériau isolant. L’ensemble de cette construction est conservé dans un boîtier en plastique dur avec un électrolyte. L’électrolyte est de l’eau et de l’acide sulfurique.
Le boîtier en plastique dur est une cellule. Une seule cellule stocke généralement 2,1V. Pour cette raison, une batterie au plomb de 12V se compose de 6 cellules et fournit 6 x 2,1V/Cellule = 12,6V typiquement.
Maintenant, quelle est la capacité de stockage de charge ?
Elle dépend fortement de la matière active (Quantité d’électrolyte) et de la taille de la plaque. Vous avez peut-être vu que la capacité de stockage des batteries au lithium est décrite en mAh ou milliampère-heure, mais dans le cas de la batterie au plomb, il s’agit d’Ampère-heure. Nous décrirons cela dans une section ultérieure.
Fonctionnement de la batterie plomb-acide
Le fonctionnement de la batterie plomb-acide est une question de chimie et il est très intéressant de le savoir. Il y a d’énormes processus chimiques qui sont impliqués dans les conditions de charge et de décharge de la batterie plomb-acide. Les molécules d’acide sulfurique dilué H2SO4 se divisent en deux parties lorsque l’acide se dissout. Elles créent des ions positifs 2H+ et des ions négatifs SO4-. Comme nous l’avons dit précédemment, deux électrodes sont connectées comme des plaques, l’anode et la cathode. L’anode capte les ions négatifs et la cathode attire les ions positifs. Cette liaison à l’Anode et SO4- et à la Cathode avec 2H+ échange des électrons et qui est ensuite réagir avec le H2O ou avec l’eau (Acide sulfurique dilué, Acide sulfurique + Eau).
La batterie a deux états de réaction chimique, Charge et Décharge.
Charge de la batterie plomb-acide
Comme nous le savons, pour charger une batterie, nous devons fournir une tension supérieure à la tension terminale. Ainsi, pour charger une batterie de 12,6 V, on peut appliquer 13 V.
Mais que se passe-t-il réellement lorsque nous chargeons une batterie plomb-acide ?
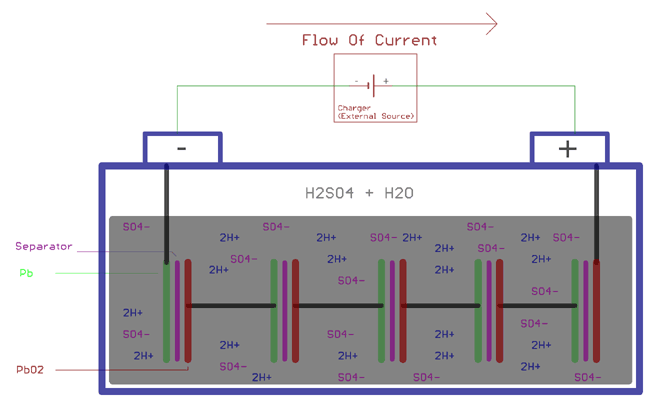
Eh bien, les mêmes réactions chimiques que nous avons décrites précédemment. Plus précisément, lorsque la batterie est connectée avec le chargeur, les molécules d’acide sulfurique se brisent en deux ions, les ions positifs 2H+ et les ions négatifs SO4-. L’hydrogène échange des électrons avec la cathode et devient de l’hydrogène, cet hydrogène réagit avec le PbSO4 dans la cathode et forme de l’acide sulfurique (H2SO4) et du plomb (Pb). D’autre part, les SO4- échangent des électrons avec l’anode et deviennent des radicaux SO4. Ce SO4 réagit avec le PbSO4 de l’anode et crée le peroxyde de plomb PbO2 et l’acide sulfurique (H2SO4). L’énergie est stockée en augmentant la gravité de l’acide sulfurique et en augmentant la tension du potentiel de la cellule.
Comme expliqué ci-dessus, les réactions chimiques suivantes ont lieu à l’anode et à la cathode pendant le processus de charge.
A la cathode
PbSO4 + 2e- => Pb + SO42-
A l’anode
PbSO4 + 2H2O => PbO2 + SO42- + 4H- + 2e-
En combinant les deux équations ci-dessus, la réaction chimique globale sera
2PbSO4 + 2H2O => PbO2 + Pb + 2H2SO4
Il existe différentes méthodes applicables pour charger la batterie plomb-acide. Chaque méthode peut être utilisée pour une batterie au plomb-acide spécifique pour des applications spécifiques. Certaines applications utilisent une méthode de charge à tension constante, d’autres une méthode à courant constant, tandis que la charge par chatouillement est également utile dans certains cas. Normalement, le fabricant de batteries fournit la méthode de charge appropriée pour les batteries au plomb-acide spécifiques. La charge à courant constant n’est pas typiquement utilisée dans la charge des batteries plomb-acide.
La méthode de charge la plus courante utilisée dans les batteries plomb-acide est la méthode de charge à tension constante qui est un processus efficace en termes de temps de charge. Dans le cycle de charge complet, la tension de charge reste constante et le courant a progressivement diminué avec l’augmentation du niveau de charge de la batterie.
Décharge de la batterie plomb-acide
La décharge d’une batterie plomb-acide est à nouveau impliquée dans des réactions chimiques. L’acide sulfurique est sous la forme diluée avec généralement un rapport de 3:1 avec l’eau et l’acide sulfurique. Lorsque les charges sont connectées aux plaques, l’acide sulfurique se décompose à nouveau en ions positifs 2H+ et en ions négatifs SO4. Les ions hydrogène réagissent avec le PbO2 et produisent du PbO et de l’eau H2O. PbO commence à réagir avec le H2SO4 et crée PbSO4 et H2O.
De l’autre côté, les ions SO4- échangent les électrons de Pb, créant le radical SO4 qui crée encore PbSO4 réagissant avec le Pb.
Comme expliqué ci-dessus, les réactions chimiques suivantes ont lieu à l’Anode et à la Cathode pendant le processus de décharge. Ces réactions sont exactement opposées aux réactions de charge :
A la cathode
Pb + SO42- => PbSO4 + 2e-
A l’anode :
PbO2 + SO42- + 4H- + 2e- => PbSO4 + 2H2O
En combinant les deux équations ci-dessus, la réaction chimique globale sera
PbO2 + Pb + 2H2SO4 => 2PbSO4 + 2H2O
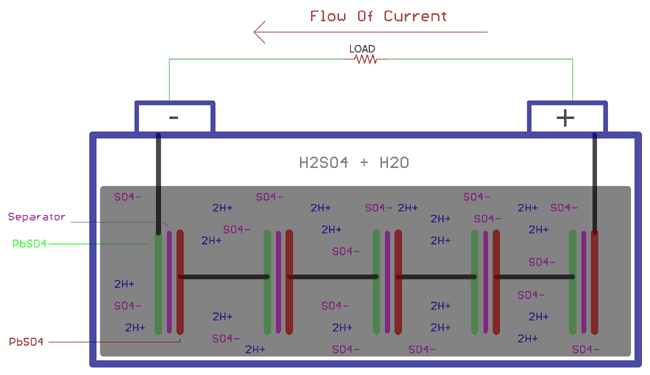
En raison de l’échange d’électrons entre l’anode et la cathode, l’équilibre électronique entre les plaques est affecté. Les électrons circulent alors à travers la charge et la batterie se décharge.
Pendant cette décharge, la gravité de l’acide sulfurique dilué diminue. De même, en même temps, la différence de potentiel de la cellule diminue.
Facteur de risque et valeurs nominales électriques
La batterie plomb-acide est nocive si elle n’est pas entretenue en toute sécurité. Comme la batterie génère du gaz Hydrogène pendant le processus chimique, elle est très dangereuse si elle n’est pas utilisée dans la zone ventilée. De plus, une charge inexacte endommage gravement la batterie.
Quelles sont les valeurs nominales standard de la batterie plomb-acide ?
Chaque batterie plomb-acide est fournie avec une fiche technique pour le courant de charge et le courant de décharge standard. Typiquement, une batterie au plomb-acide de 12V qui est applicable pour l’application automobile pourrait être comprise entre 100Ah et 350Ah. Cette cote est définie comme la cote de décharge avec une période de temps de 8 heures.
Par exemple, une batterie de 160Ah pourrait fournir 20A de courant d’alimentation à la charge pendant 8 heures de la portée. On peut tirer plus de courant mais il n’est pas conseillé de le faire. En tirant plus de courant que le courant de décharge maximum en ce qui concerne 8 heures endommagera l’efficacité de la batterie et la résistance interne de la batterie pourrait également être modifiée, ce qui augmente encore la température de la batterie.
D’autre part, pendant la phase de charge, nous devrions faire attention à la polarité du chargeur, il devrait être correctement connecté avec la polarité de la batterie. L’inversion de polarité est dangereuse pour la charge de la batterie au plomb. Le chargeur prêt à l’emploi est équipé d’un compteur de tension et de courant de charge avec une option de contrôle. Il faut fournir une tension supérieure à la tension de la batterie pour charger la batterie. Le courant de charge maximal doit être le même que le courant d’alimentation maximal à un taux de décharge de 8 heures. Si nous prenons le même exemple 12V 160Ah, alors le courant d’alimentation maximum est de 20A, donc le courant de charge maximum sûr est le 20A.
Nous ne devrions pas augmenter ou fournir un courant de charge important car cela entraînera de la chaleur et une augmentation de la production de gaz.
Règles d’entretien des batteries au plomb-acide
- L’arrosage est la caractéristique d’entretien la plus négligée des batteries au plomb-acide inondées. Comme la surcharge diminue l’eau, nous devons la vérifier fréquemment. Moins d’eau crée une oxydation dans les plaques et diminue la durée de vie de la batterie. Ajoutez de l’eau distillée ou ionisée au besoin.
- Vérifiez les évents, ils doivent être perfectionnés avec des bouchons en caoutchouc, souvent les bouchons en caoutchouc collent avec les trous trop serrés.
- Rechargez les batteries au plomb après chaque utilisation. Une longue période sans recharge fournit une sulfatation dans les plaques.
- Ne pas geler la batterie ou la charger plus de 49 degrés centigrades. Dans une ambiance froide, les batteries doivent être complètement chargées car les batteries complètement chargées sont plus sûres que les batteries vides en ce qui concerne le gel.
- Ne pas décharger profondément la batterie en dessous de 1,7V par cellule.
- Pour stocker une batterie au plomb, elle doit être complètement chargée puis l’électrolyte doit être drainé. La batterie devient alors sèche et peut être stockée pendant une longue période.
.