Sjögrenin oireyhtymän diagnostiikka ja hoito
Tausta: Sjögrenin oireyhtymä on yksi yleisimmistä tulehduksellisista reumatologisista sairauksista, jonka esiintyvyys Saksassa on vähintään 0,4 %.
Menetelmät: Tämä katsaus perustuu asiaan liittyviin artikkeleihin, jotka on haettu valikoidulla haulla PubMedistä. Erityistä huomiota kiinnitetään päivitettyihin luokittelukriteereihin ja nykyisiin hoitosuosituksiin.
Tulokset: Sjögrenin oireyhtymällä on monenlaisia esiintymismuotoja, jotka vaihtelevat eksokriinisten rauhasten paikallisesta osallistumisesta, johon liittyy keratoconjunctivitis sicca ja kserostomia (taudin johtavat oireet), systeemiseen, ekstraglandulaariseen osallistumiseen useisiin elimiin. Väsymys heikentää myös huomattavasti potilaiden elämänlaatua. Serologisissa testeissä havaitaan antinukleaarisia autovasta-aineita (anti-Ro/SSA ja anti-La/SSB) sekä reumatekijöitä. Taudin histologinen tunnusmerkki on fokaalinen lymfosyyttinen infiltraatio muuten normaalilta näyttävissä rauhasihottumissa. Tauti lisää myös huomattavasti B-solusarjan non-Hodgkin-lymfooman riskiä, joka ilmaantuu noin 5 prosentille potilaista. Primaarinen Sjögrenin oireyhtymä (pSS) eroaa sekundaarisesta muodosta (sSS), joka ilmaantuu jonkin muun autoimmuunisairauden, erityisesti systeemisen lupus erythematosuksen (15-36 %), nivelreuman (20-32 %) ja rajoittuneen tai etenevän systeemisen skleroosin (11-24 %) yhteydessä. Sairautta muuttava hoito on varattu potilaille, joilla on systeeminen sairaus, ja sen tehosta on vain vähän näyttöä. Taudin monimutkaisuuden vuoksi jotkin sen kliiniset ilmenemismuodot saattavat vaatia monialaista hoitoa.
Johtopäätös: Sjögrenin tautia sairastavien potilaiden monialaisessa hoidossa tärkeimpiä näkökohtia ovat toimenpiteet elämänlaadun parantamiseksi, farmakologiset ja ei-farmakologiset hoidot taudin aktiivisuuden kurissa pitämiseksi ja lymfoomariskin hallinta. Tulevaisuuden hoitomenetelmissä on otettava huomioon taudin heterogeenisuus.
![]()
![]()
Sjögrenin oireyhtymä on tuntematonta alkuperää oleva krooninen tulehduksellinen autoimmuunisairaus, joka hyökkää erityisesti kyynel- ja sylkirauhasiin. Sicca-oireet ovat taudin tunnusmerkkejä, joihin voi liittyä myös erilaisia elimellisiä ilmenemismuotoja. Merkkien ja oireiden moninaisuuden vuoksi Sjögrenin oireyhtymää sairastavat potilaat saattavat tavata ensimmäisellä vastaanotollaan monenlaisia terveydenhuollon ammattilaisia, kuten perhelääkäreitä, silmälääkäreitä, korva-, nenä- ja kurkkutautien erikoislääkäreitä ja hammaslääkäreitä. Näin ollen on ratkaisevan tärkeää, että eri erikoisalojen lääkärit ovat perillä taudin kliinisten ilmenemismuotojen ajankohtaisista näkökohdista, tarkistetuista luokittelukriteereistä ja nykyisistä hoitovaihtoehdoista.
Primäärinen Sjögrenin oireyhtymä (pSS) erotetaan sekundaarisesta Sjögrenin oireyhtymästä (sSS), jota esiintyy osana muita autoimmuunisairauksia. SSS esiintyy erityisesti systeemisen lupus erythematosuksen (15-36 %), nivelreuman (20-32 %) sekä rajoittuneen ja etenevän systeemisen skleroosin (11-24 %), harvemmin multippeliskleroosin ja autoimmuunihepatiitin ja tyreoidiitin yhteydessä (1). Termi ”sekundaarinen” ei tässä yhteydessä kuvaa taudin ilmenemisen kronologista järjestystä: Perussairaus voi aluksi esiintyä sicca-oireilla ja paljastua vasta myöhemmin taudin edetessä. Diagnoosin asettaminen on usein haastavaa potilailla, joilla on päällekkäisiä tautikokonaisuuksia. Koska taudinkulku (myös ennuste) on erilainen, on tärkeää tehdä ero Sjögrenin oireyhtymän primaarisen ja sekundaarisen muodon välillä.
Epidemiologia
Sjögrenin oireyhtymää koskevien saatavilla olevien esiintyvyys- ja ilmaantuvuustietojen heterogeenisuus selittyy eroilla tutkimusasetelmassa ja luokitteluperusteissa. Harvinaisemmalle pSS:lle laskettu maailmanlaajuinen esiintyvyys on 61 tapausta 100 000 asukasta kohti, ja suurin esiintyvyys on Euroopassa (2). Naiset sairastuvat Sjögrenin oireyhtymään huomattavasti useammin kuin miehet; sukupuoliero vaihtelee 9:1:stä 19:1:een. Keski-ikä pSS:n ensidiagnoosin yhteydessä on 56 vuotta, ja toinen huippu on 20 ja 40 vuoden välillä. Ensimmäiset oireet voivat kuitenkin ilmaantua jo vuosia ennen diagnoosia. Saksasta ei vielä ole luotettavia epidemiologisia tietoja. Sjögrenin oireyhtymän kokonaisesiintyvyyden, mukaan lukien taudin yleisempi sekundaarinen muoto, oletetaan olevan vähintään 0,4 % (3).
Kliininen ilmenemismuoto
Nykyisimmän tähän mennessä julkaistun kohortin mukaan sicca-oireet ovat Sjögrenin oireyhtymän yleisin ilmenemismuoto, jopa 98 % tapauksista (4). Keratokonjunktiviitti siccaa (KCS) sairastavat potilaat valittavat vierasesineen tuntemusta, silmien kirvelyä tai arkuutta ja lisääntynyttä valoherkkyyttä. Merkittävä kserostomia, joka on merkki stomatitis siccasta, ilmenee kliinisesti vaikeutena, kun puhutaan pitkiä aikoja ja kun pureskellaan tai syljetään kuivaa ruokaa. Yleisväestöön verrattuna karieksen ja varhaisen hampaiden menetyksen esiintyvyys on noin kaksi kertaa suurempi Sjögrenin oireyhtymää sairastavilla potilailla, ja heidän suun terveyteen liittyvä elämänlaatunsa on merkittävästi heikentynyt. Candida albicansin aiheuttamia toistuvia suun infektioita esiintyy 10 kertaa useammin kuin väestössä yleensä (5). Toisaalta sicca-oireita raportoidaan yleisesti ikääntymisen ja monilääkityksen myötä: Noin 5-35 prosenttia väestöstä kärsii silmien kuivuudesta (6), ja noin 20 prosenttia hammaslääkäripotilaista kärsii suun kuivuudesta (7). Näin ollen perusteellinen anamneesi, lääkitys mukaan luettuna, ja fyysinen tutkimus, jota seuraavat erityiset toimintakokeet, ovat ratkaisevan tärkeitä näiden vaivojen tulkinnassa. Taulukossa 1 luetellaan rauhasvaivojen erotusdiagnoosit. Lisäksi on kiinnitettävä huomiota muihin sicca-oireisiin, kuten kuivaan yskään tracheobronchitis siccassa tai sicca-oireisiin nenänielussa tai sukupuolielimissä, jotka ilmenevät lisääntyneenä infektioherkkyytenä tai dyspareuniana.
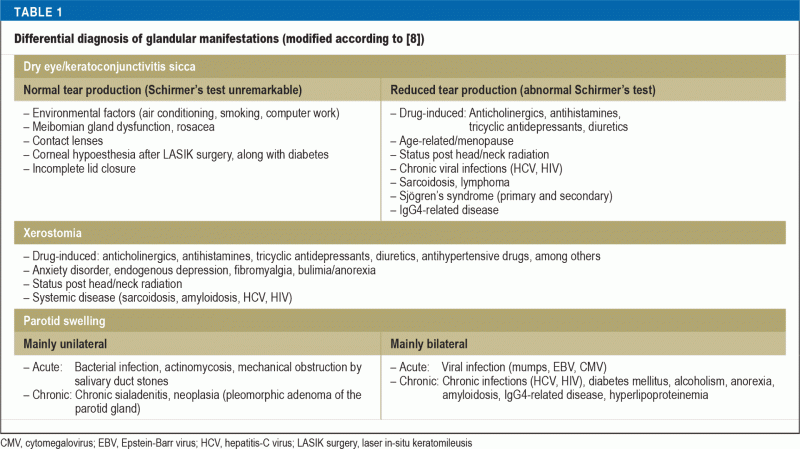
Jopa 34 %:lla Sjögrenin oireyhtymää sairastavista potilaista raportoidaan episodista tai kroonista, tyypillisesti molemminpuolista korvasylkirauhasten turvotusta (9). Tässä yhteydessä on olennaista sulkea pois pahanlaatuinen B-solulinjan non-Hodgkin-lymfooma (NHL), jota esiintyy noin 5 %:lla pSS-potilaista (10), joilla on huomattavasti suurempi riski sairastua NHL:ään kuin väestössä yleensä (riskisuhde : 13,7). Keskeisiä NHL:n kehittymistä ennustavia tekijöitä ovat matalat komplementtipitoisuudet (RR: 8,3), kryoglobulinemia (RR: 6,8), lymfadenopatia (RR: 3,7), ektooppisten itukeskusten kaltaisten rakenteiden histologinen löytyminen, parotisrauhasen jatkuva turpoaminen ja ihon vaskuliitti (10, 11). Nämä potilaat kuuluvat korkean riskin ryhmään, ja he tarvitsevat seurantaa tiheämmin väliajoin ja tarvittaessa diagnostisia lisätutkimuksia, kuten rintakehän röntgenkuvausta ja vatsaontelon ultraäänitutkimusta; päteviä suosituksia lymfooman seulonnasta ei kuitenkaan ole saatavilla.
Yleisimpiä ekstraglandulaarisia ilmenemismuotoja ovat niveltulehdus ja tavallisesti ei-eroosioaltis moniniveltulehdus, joita esiintyy noin 50 %:lla potilasta (9). Sicca-kompleksin ulkopuolinen keuhkoahtauma ilmenee tyypillisesti interstitiaalisena keuhkosairautena tai follikulaarisena bronkioliittina, yleensä useiden vuosien tautiaktiivisuuden jälkeen (9-12 %) (9, 12). Noin 10 %:lla potilaista on ihovaurioita, joista suurin osa on vaskuliitteja, jotka koskevat alaraajojen pieniä ja keskisuuria verisuonia. Lisäksi voi esiintyä muita harvinaisempia ihomuutoksia, kuten rengasmaista eryteemaa, nokkosihottumaa tai hypergammaglobulinemista purppuraa (9). Munuaisvaurio, jota esiintyy noin 5 %:lla potilaista, liittyy yleensä tubulointerstitiaalisiin muutoksiin, joihin liittyy usein distaalinen munuaistubulaarinen asidoosi (RTA tyyppi 1), johon liittyy hypokaleeminen lihashypotonia; glomerulonefriitti on harvinainen pSS-potilailla (9, 13).
Kliinisesti merkityksellistä on myös perifeerisen hermoston osallistuminen, erityisesti taudin myöhemmässä vaiheessa, joka ilmenee tyypillisesti sensorisena neuropationa (10-25 %) (9, 14). Harvinaisempia ja haastavampia tunnistaa ovat keskushermoston ilmenemismuodot; esimerkiksi magneettikuvauksessa todettujen multifokaalisten keskushermostovaurioiden erotusdiagnostiikkaan kuuluvat multippeliskleroosin leesiot, joita on vaikea erottaa pSS:n leesioista (15). Tässä yhteydessä pSS:n ja neuromyelitis optica -spektrin häiriöiden (NMOSD) samanaikainen esiintyminen, joille on ominaista akvaporin-4:n vasta-aineet, on tärkeää (4). Jos potilaiden testi on positiivinen tämän vasta-aineen suhteen, sillä on suuri erotusdiagnostinen merkitys.
Epäspesifiset vaivat, kuten väsymys ja diffuusi kipu, ovat sen sijaan vaikeammin arvioitavissa. Väsymys on kuitenkin oire, jonka potilas kokee kaikkein ahdistavimmaksi ja joka määrittää lääkärikäyntien tiheyden, elämänlaadun sekä työkyvyn (16, e1). Muut väsymyksen erotusdiagnoosiin kuuluvat sairaudet, kuten kilpirauhasen vajaatoiminta, anemia ja unihäiriöt, on suljettava pois, ja myös sairauden kanssa selviytymisen vaikeudet on otettava huomioon.
Ro/SSA- ja La/SSB-positiiviset naiset, jotka haluavat saada lapsia, tarvitsevat erityisneuvontaa. Näiden vasta-aineiden siirtyminen istukan kautta voi aiheuttaa tulehduksen ja sitä seuraavan eteis-kammiosolmukkeen (AV-solmukkeen) skleroosin, johon liittyy riski, että sikiölle kehittyy synnynnäinen sydänkatkos. Tapauksista 80 prosentissa syntyy täydellinen peruuttamaton sydänkatkos, ja 20 prosentissa tapauksista sikiökuolleisuus on merkittävästi lisääntynyt (17). Sikiön sydämen rytmin viikoittainen ultraääniseuranta 16. ja 31. raskausviikon välisenä aikana on olennaista sekä ennusteen arvioinnin että hoidon kannalta.
Prognoosi
Kaiken kaikkiaan Sjögrenin oireyhtymän ennuste on suotuisa. PSS-potilaiden elinajanodote on verrattavissa yleisväestön elinajanodotteeseen (18). Potilaiden elämänlaatua heikentävät kuitenkin taudin moninaiset ilmenemismuodot. Sydän- ja verisuonitaudit, infektiot, kiinteät kasvaimet ja lymfooma ovat tärkeimmät kuolinsyyt. Sjögrenin oireyhtymää sairastavilla potilailla elinajanodote määräytyy perussairauden mukaan.
Patogeneesi
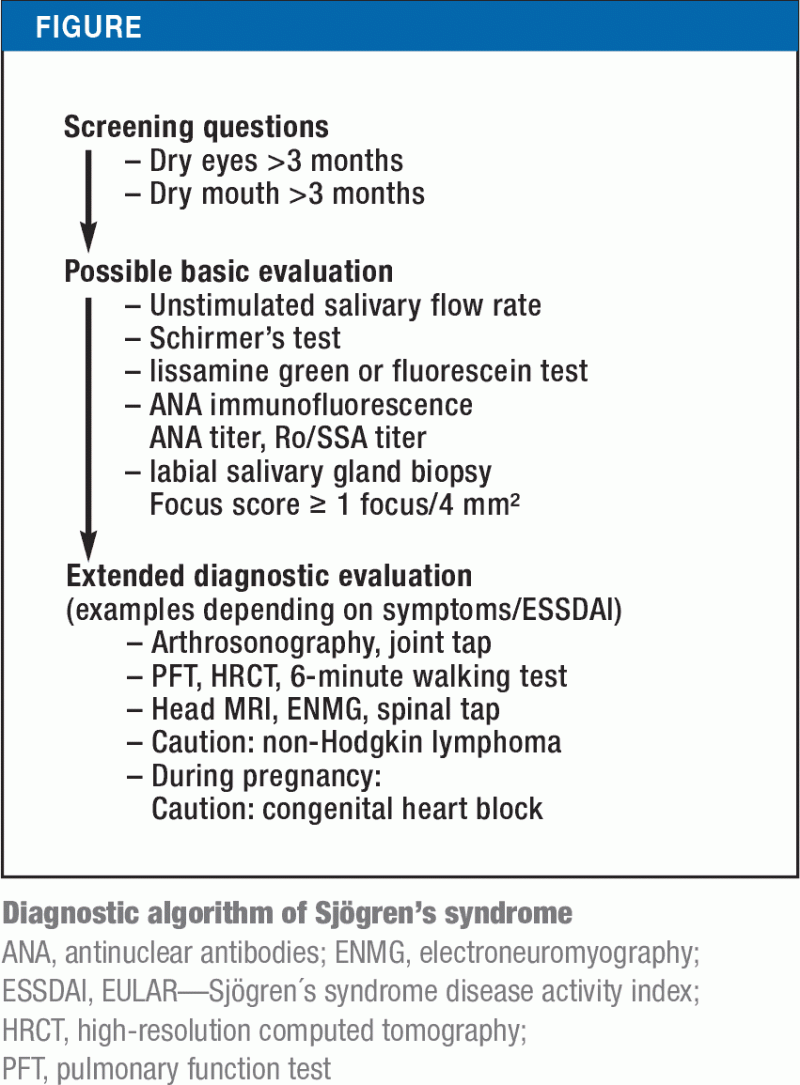
Kuten useimpien autoimmuunisairauksien kohdalla, Sjögrenin oireyhtymän etiologiaa ei vielä täysin tunneta (e2-e5, 19). Hiljattain tärkeimpien järjestöjen, ACR:n (American College of Rheumatology) ja EULAR:n (European League Against Rheumatism), nykyiseen luokitukseen sisällytettiin ensimmäistä kertaa nykyiset yhdysvaltalaiset kriteerit vuodelta 2012. Potilailla, joilla on ollut sicca-oireita vähintään kolmen kuukauden ajan, nämä perustuvat lisätoimintakokeisiin (esim. Schirmerin testi) tai serologisiin (Anti-Ro/SSA) ja histologisiin tutkimuksiin (labiaalinen sylkirauhasbiopsia). Näistä tutkimuksista anti-Ro/SSA-vasta-aineilla ja epänormaalilla sylkirauhasen biopsialla on korkein spesifisyys, joten ne ovat kriteerit, joilla on korkeimmat arvot. Sjögrenin oireyhtymä voidaan luokitella Sjögrenin oireyhtymäksi vähintään pistemäärän 4 perusteella (laatikko). Kuvassa esitetään Sjögrenin oireyhtymän diagnostinen algoritmi, joka perustuu tarkistettuihin luokittelukriteereihin ja taudin eri ilmenemismuotoihin.



Objektiiviset testit sicca-oireiden selvittämiseksi
Schirmerin koe ja Saxonin koe ovat helppoja tehdä, mutta niiden tulokset eivät korreloi hyvin potilaan valitusten kanssa, ja niitä on arvioitava yleisessä kontekstissa. Tässä yhteydessä yhteistyö silmätautien osaston kanssa on ratkaisevan tärkeää: Elintärkeiden väriaineiden (lissamiinivihreä tai fluoresceiini) paikallista käyttöä käytetään sarveiskalvon ja sidekalvon vaurioiden visualisoimiseksi ja luokittelemiseksi keratokonjunktiviitti siccaan liittyen. Suora syljenerityksen mittaaminen on diagnostinen kultainen standardi, mutta se on aikaa vievää päivittäisessä kliinisessä käytännössä. Parotis-sialografia ja sylkirauhasten sintigrafia eivät ole riittävän spesifisiä. Tärkeimpien sylkirauhasten ultraäänitutkimus ei-invasiivisena menetelmänä on olennainen osa päivittäistä kliinistä käytäntöä. Menetelmää ei kuitenkaan ole vielä validoitu riittävästi, jotta se voitaisiin sisällyttää luokittelukriteereihin (21).
Laboratoriokokeet
Ammunofluoresenssitestaus antinukleaaristen vasta-aineiden (ANA) varalta on erittäin tärkeä sidekudossairauksien diagnosoinnissa. Jopa 83 %:lla pSS-potilaista ANA-testi on positiivinen (22). Kuitenkin matala titraus (23). Potilailla, joilla on positiivinen ANA-tiitteri, hieno pilkullinen fluoresenssikuvio viittaa vahvasti anti-Ro/SSA ja/tai anti-La/SSB-vasta-aineisiin, jotka ilmenevät noin 40-75 prosentilla ja 23-52 prosentilla pSS-potilaista (24). Koska anti-Ro/SSA-vasta-aineiden diagnostinen arvo on viime aikoina noussut nykyisessä luokitusjärjestelmässä, voidaan olettaa, että huomattavasti useammalla äskettäin luokitellulla Sjögrenin oireyhtymää sairastavalla potilaalla on kohonnut vasta-ainepitoisuus verrattuna aiempiin kohortteihin. Positiiviset vasta-ainetitterit korreloivat taudin varhaisen puhkeamisen, voimakkaamman kudosinfiltraation ja ekstraglandulaaristen ilmentymien suuremman esiintyvyyden kanssa. Kuitenkin myös muita sidekudossairauksia sairastavilla potilailla voi esiintyä positiivisia anti-Ro/SSA-vasta-aineita. Kliininen konteksti on tässä yhteydessä elintärkeä, erityisesti päällekkäisten tautikokonaisuuksien erottamiseksi toisistaan. Mielenkiintoista on, että serologisia autoimmuuni-ilmiöitä on havaittu jopa 20 vuotta ennen taudin ensimmäisten oireiden ilmaantumista (25). Muita serologisia poikkeavuuksia ovat muun muassa reumatekijöiden esiintyminen (60-75 %) sekä polyklonaalinen hypergammaglobulinemia merkkinä B-solujen lisääntyneestä aktiivisuudesta.
Biomarkkereiden kehittäminen, joka tarjoaa ennustetietoa ja keinon seurata taudin etenemistä, on nyt saavuttanut vakiintuneen vaiheen. Immunoglobuliinien beeta2-mikroglobuliinin ja vapaiden kevytketjujen lisääntyminen liittyy lisääntyneeseen lymfoomariskiin (26). Siglec-1 on viime aikoina noussut esiin uutena biomarkkerina. Tämä epäsuora interferonimarkkeri korreloi korkean tautiaktiivisuuden sekä ekstraglandulaaristen ilmentymien kanssa (27).
Histopatologia
Histopatologinen löydös, jossa eksokriinisessä rauhaskudoksessa on fokaalisia periduktaalisesti lokalisoituneita lymfosyytti-infiltraatteja yhdessä muutoin ehjien akinaariyksikköjen kanssa, on patognomoninen Sjögrenin oireyhtymälle. Nämä infiltraatiot koostuvat enimmäkseen CD4+ T-soluista, joiden lisäksi on joitakin CD8+ T-soluja ja CD19+ B-soluja, plasmasoluja ja dendriittisoluja. Syvällinen asiantuntemus histopatologisten löydösten tulkintaa koskevien kansainvälisten suositusten mukaisesti on tarpeen, jotta Sjögrenin oireyhtymä voidaan erottaa muista tautikokonaisuuksista (28). Vähintään 50 monosyyttistä solua/4 mm² määriteltiin fokus-pistemääräksi (FS) 1. Fokus-pistemäärä ≥1 korreloi Sjögrenin oireyhtymän fenotyyppisten piirteiden kanssa.
Hoito
Taudin patogeneesiin osallistuvien mekanismien ymmärtämisessä tapahtuneesta jatkuvasta edistymisestä huolimatta Sjögrenin oireyhtymän kohdennettua hoitoa ei ole tällä hetkellä saatavilla. Hoidosta päätetään yksilöllisesti taudin aktiivisuuden sekä ekstraglandulaaristen ilmentymien esiintymisen ja laajuuden mukaan. SSS-potilaiden hoitoindikaatio perustuu perussairauteen. Yleensä hoidosta olisi huolehdittava monialainen tiimi, johon kuuluu perhelääkäreitä, reumatologeja, silmälääkäreitä ja ETN-asiantuntijoita sekä hammaslääkäreitä. Asianomaisista elimistä ja oireista riippuen voi olla tarpeen konsultoida muita erikoislääkäreitä (gynekologeja, keuhkolääkäreitä, neurologeja jne.). Sairautta muuttava hoito on varattu potilaille, joilla on ekstraglandulaarinen osallistuminen. Systeemisen tautiaktiivisuuden mittaamiseksi on kehitetty ja validoitu EULAR Sjögrenin oireyhtymän tautiaktiivisuusindeksi (EULAR Sjögren’s Syndrome Disease Activity Index, ESSDAI) (29, e7).
Sicca-oireiden hoito
Useimmilla potilailla hoidon päätavoitteena on elämänlaadun parantaminen sicca- ja väsymysoireita hoitamalla. Samalla tämä on erittäin haastava tehtävä lääkäreille, koska näyttöön perustuvia hoitovaihtoehtoja on vähän ja useimmat hoitokeinot ovat vain oireenmukaisia (taulukko 2). Potilaiden valistuksella on tärkeä rooli, ja siinä keskitytään arkipäivän käyttäytymissääntöjen noudattamiseen (30) – ympäristötekijöihin (esim. ilman kostuttaminen), ennaltaehkäisyyn (esim. fluori karieksen ehkäisemiseksi, tupakoinnin lopettaminen) ja väsymystä lisäävien tekijöiden välttämiseen (esim, unihygienia) sekä fyysinen kunto (aerobinen kestävyysharjoittelu väsymyksen torjumiseksi).
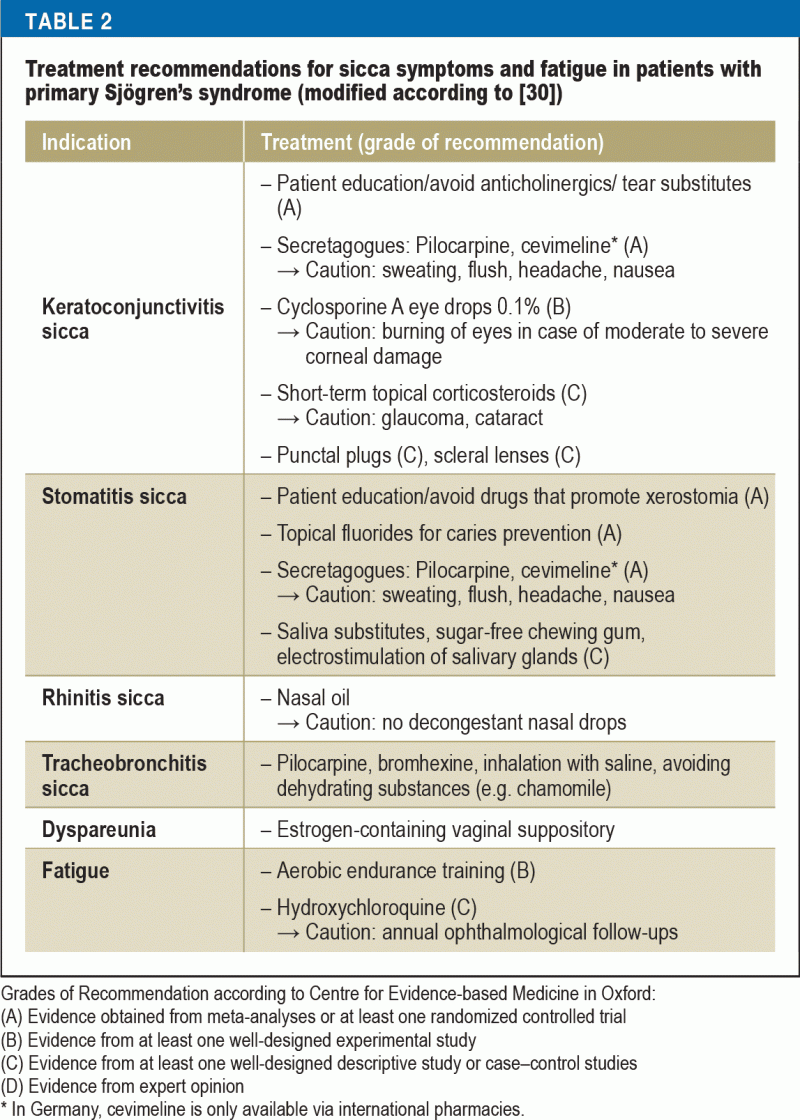
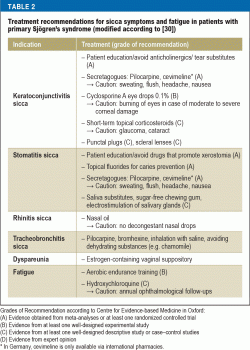
Vaihtelevia kyynelkorvikkeita on saatavana keratoconjunctivitis siccan hoitoon. Kyynelkorvikkeiden koostumus vaihtelee kolmikerroksisen preokulaarisen kyynelfilmin (lipidikerros, vesikerros ja mukiinikerros) monimutkaisen fysiologian mukaisesti. Koska immuunivälitteiset mekanismit ovat keskeisessä asemassa kuivasilmäisyyden patogeneesissä, tulehdusta ehkäisevä hoito syklosporiini A -silmätipoilla on saanut merkittävän merkityksen. Niiden teho on osoitettu satunnaistetuissa kontrolloiduissa tutkimuksissa, ja näistä tutkimuksista saatujen tietojen perusteella 0,1-prosenttinen kationinen siklosporiini A -emulsio sai myyntiluvan Euroopan lääkevirastolta (31). Näiden potilaiden elämänlaatua merkittävästi parantavia lisätoimenpiteitä ovat muun muassa punktitulppien käyttö ja erittäin suurten piilolinssien (”skleraalilinssien”) sovittaminen, joissa on veden varastointitoiminto (32). Näin ollen yhteistyö silmälääkäreiden kanssa on välttämätöntä.
Xerostomiaa hoitavat yhdessä hammaslääkärit ja korva- ja nielulääkärit. Suun limakalvopinta on verrattain suuri, ja suuontelon eri rakenteita on kostutettava (kieli, hampaat, ikenet, suun limakalvo). Lisäksi syljen koostumus vaihtelee toiminnon ja vuorokaudenajan mukaan. Syljen monimutkaisten toimintojen optimaalista terapeuttista kompensaatiota ei voida saavuttaa. Kaksi systemaattista katsausta ajankohtaisista/ei-lääkkeellisistä hoidoista päätyvät siihen, että vaikka oireita voidaan lievittää, syljen virtausta ei voida lisätä (33, 34). Kserostomiapotilaiden hammashoito on erityisen haastavaa, sillä syljen puute heikentää irrotettavien hammasproteesien siedettävyyttä. Sen sijaan Sjögrenin oireyhtymää sairastavilla potilailla saavutetaan hyviä tuloksia hammasimplanttihoidolla (35).
Tautia muuttava hoito
Päätös hoidon tehostamisesta riippuu taudin aktiivisuudesta ja kyseessä olevasta elinjärjestelmästä. Niistä harvoista RCT-tutkimuksista, joissa arvioitiin tavanomaisten tautia muuttavien reumalääkkeiden (DMARD-lääkkeiden) tai biologisten aineiden käyttöä Sjögrenin oireyhtymää sairastavilla potilailla, ei kuitenkaan saatu vakuuttavaa näyttöä niiden tehon tueksi (30, 36). Hoitopäätökset perustuvat usein kokemuksiin samankaltaisista reumasairauksista, kuten systeemisestä lupus erythematosuksesta. Analogisesti muihin sidekudossairauksiin hydroksiklorokiini, aine, jolla on suotuisa sivuvaikutusprofiili, on valintalääke erilaisiin lieviin tai keskivaikeisiin systeemisiin ilmenemismuotoihin, kuten niveltulehdukseen, niveltulehdukseen, ihomuutoksiin ja väsymykseen. Hydroksiklorokiinin esimerkki korostaa tutkimussuunnitteluun ja hoidosta mahdollisesti hyötyvien potilaiden valintaan liittyviä haasteita. PSS:ää koskevassa satunnaistetussa kontrolloidussa tutkimuksessa ei havaittu eroa hydroksiklorokiinin ja lumelääkkeen välillä sicca-oireiden, kivun ja väsymyksen osalta 24 viikon jälkeen (37). Tässä tutkimuksessa oli kuitenkin merkittäviä rajoituksia: Taudin aktiivisuus näillä potilailla oli vähäistä, seuranta-aika lyhyt ja ensisijaista päätetapahtumaa ei ollut validoitu. Tätä heterogeenista tautia tutkivien tulevien RCT-tutkimusten validiteetin lisäämiseksi on tärkeää rekrytoida edustavia potilasryhmiä ja valita vankat ensisijaiset päätetapahtumat.
Väsymyksen osalta pilottitutkimus osoitti rituksimabin kohtalaista tehoa (38). Valitettavasti tätä ei vahvistettu joitakin vuosia myöhemmin tehdyssä laajassa RCT-tutkimuksessa (39).
Immunosuppressiota koskevat hoitosuositukset vaihtelevat elinten osallistumisen mukaan (taulukko 3). Potilailla, joilla on vakavia elimellisiä ilmenemismuotoja, suuriannoksisen metyyliprednisolonin ja syklofosfamidin käyttö on todistetusti tehokasta. Vaikeassa vaskuliitissa, erityisesti jos siihen liittyy samanaikainen kryoglobulinemia, rituksimabi tai plasmafereesi ovat suositeltavia hoitovaihtoehtoja. NHL-potilaiden hoito valitaan alaluokan ja vaiheen perusteella hemato-onkologisten sairauksien hoitoa koskevien nykyisten ohjeiden mukaisesti.
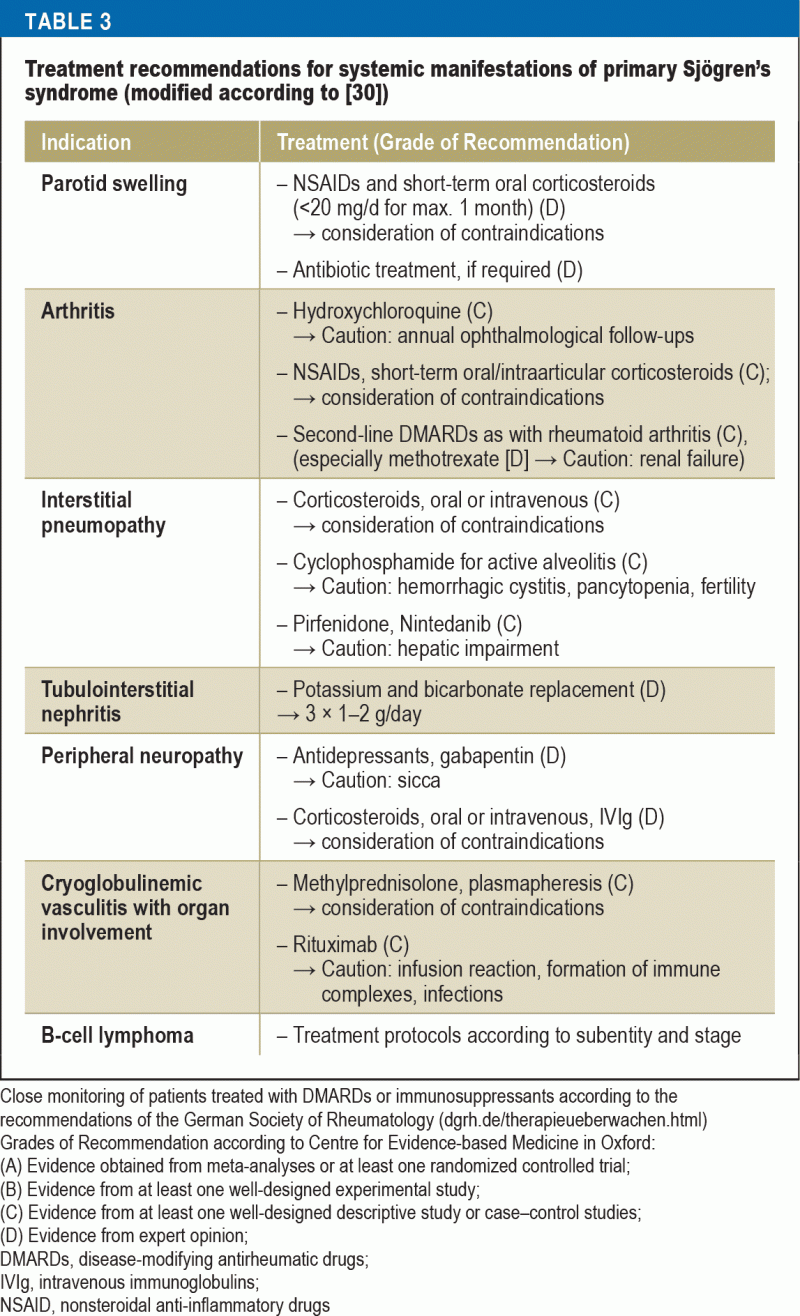
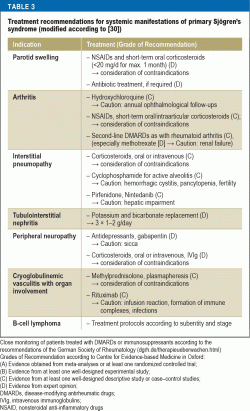
Riskin minimoimiseksi suositeltu hoito raskaana oleville naisille, joilla on Sjögrenin oireyhtymä ja joilla on suuri synnynnäisen sydämen salpauksen riski, on hydroksiklorokiini; tämä suositus perustuu kuitenkin ainoastaan retrospektiivisistä tutkimuksista saatuun näyttöön (40).
Uusia patofysiologisiin mekanismeihin kohdistuvia hoitokeinoja arvioidaan parhaillaan RCT-tutkimuksissa validoiduilla välineillä (ESSDAI): B-solujen hyperaktiivisuuden modulointi (esim, belimumabi), T-solujen yhteisstimulaation antagonismi (esim. abatasepti), efektorisytokiinit (esim. interleukiini-6-reseptori/tocilizumabi; interferoni α/anifrolumabi) sekä ektooppisten itukeskusten kaltaisten rakenteiden muodostumisen estäminen (esim. lymfotoksiini-βR-blokkaus). Näissä tutkimuksissa on haasteena tehon osoittaminen kolmen oirekompleksin – syövän, väsymyksen ja ekstraglandulaaristen ilmenemismuotojen – osalta.
Kiinnostuksenrajoitusilmoitus
Prof. Dörner on saanut konsulttipalkkioita UCB:ltä, Novartikselta ja Rochelta sekä rahallista tukea kliinisten tutkimusten suorittamiseen UCB:ltä ja Novartikselta.
Prof. Pleyer on saanut konsulttipalkkioita ja luennointipalkkioita Santenilta, Théalta ja Allerganilta.
Prof. Burmester on saanut taloudellista tukea kliinisten tutkimusten suorittamiseen Novartisilta, UCB:ltä ja Rochelta.
Tohtori Stefanski, tohtori Tomiak ja professori Dietrich ilmoittavat, ettei eturistiriitoja ole.
Käsikirjoitus vastaanotettu 13.12.2016; tarkistettu versio hyväksytty 14.3.2017
Käännöksen alkuperäisestä saksankielestä tehnyt Ralf Thoene, MD.
Vastaava kirjoittaja
Dr. med. Ana-Luisa Stefanski
Charite Universitatsmedizin Berlin
Rheumatologie und klinische Immunologie
Charitéplatz 1
10117 Berliini, Saksa
[email protected]
Lisäaineisto
Editetyt viitteet osoitteessa:
www.aerzteblatt-international.de/ref2017
eKuvio:
www.aerzteblatt-international.de/17m0354
.