Hiv-taudin parantaminen kantasoluhoidolla
Science Highlights by Ann A. Kiessling, PhD
- Lataa tai tulosta tämä artikkeli PDF-muodossa
Mitä on HIV-tauti?
Ihmisen immuunipuutosvirus (HI-virus, HIV) infektoi tietyntyyppisiä immuunijärjestelmän soluja. Kuten useimmat virukset, jotta HIV voi tartuttaa solun, viruksen on sitouduttava tiettyyn proteiiniin, jota kutsutaan reseptoriksi, solun pinnalla. Immuunijärjestelmässämme on monia erilaisia solutyyppejä, ja jokaisella on oma tehtävänsä bakteeri- ja virusinfektioiden torjunnassa. Kehomme tuottaa päivittäin miljardeja uusia immuunisoluja luuytimen kantasoluvarastoista.
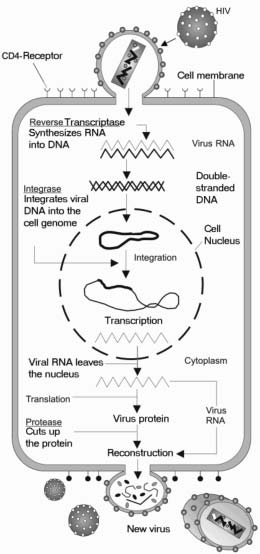
HIV:llä on monimutkainen elinkaari, johon kuuluu, että siitä tulee osa isäntäsolun geneettistä informaatiota, joten solu on infektoitunut koko elämänsä ajan. Tartunta voi olla lepotilassa, jolloin uutta virusta ei synny, tai aktiivinen, jolloin uutta virusta syntyy jatkuvasti
HIV tarttuu immuunisoluihin, joiden pinnalla on CD4-niminen proteiini. Osa HIV-tartunnan saaneista CD4-soluista kuolee, mutta osa jää elimistöön valmiina torjumaan uutta infektiota myöhemmin. Kun hiv-tartunnan saanut henkilö kohtaa uuden infektion, kuten flunssan, tai infektoituneen vamman, hiv-tartunnan saanut CD4-solu reagoi immuunijärjestelmän luotettavan jäsenen tavoin. Se aktivoituu, lisääntyy ja tuottaa sivuvaikutuksena uusia HIV-hiukkasia ennen kuolemaansa. Uudet HIV-hiukkaset tartuttavat sitten uusia CD4-soluja, jolloin sykli toistuu. Koska uusia immuunisoluja syntyy miljardeja joka päivä, kestää yleensä useita vuosia, ennen kuin HIV-tartunnan saanut henkilö menettää niin paljon CD4-soluja, että se vaikuttaa kielteisesti hänen kykyynsä torjua muita infektioita. Kun CD4-solujen määrä on ehtynyt niin paljon, että henkilö ei enää pysty tehokkaasti torjumaan uusia infektioita, hänen HIV-tautinsa on edennyt uudeksi tilaksi, jota kutsutaan hankituksi immuunipuutosoireyhtymäksi (aids).
Viruksen reseptori: solun pinnalla oleva proteiini, jonka avulla virus voi sitoutua soluun ja tunkeutua solun sisään tartuttaakseen sen
Onko HIV-infektioon olemassa parannuskeinoa?
Ei. Sitä hoidetaan tällä hetkellä lääkkeillä, jotka estävät tiettyjä vaiheita HIV-infektion elinkaaressa CD4-soluissa, mutta koska jotkut CD4-solut elävät vuosikymmeniä, eivätkä HIV-lääkkeet tapa niitä, niiden mahdollisuus aktivoitua, lisääntyä ja synnyttää uusia virushiukkasia säilyy vuosikymmeniä. Immuunisolujen pitkäikäisyys on tärkeää tautimuistin kannalta, eli se on syy siihen, miksi aikuiset eivät sairastu lapsuuden tauteihin, kuten vesirokkoihin, ja syy siihen, että rokotukset tehoavat polion kaltaisia tauteja vastaan vuosikymmeniä.
Immuunijärjestelmä: kokoelma soluja, jotka reagoivat infektioihin ja vieraiden solujen tunkeutujiin ja eliminoivat ne
voivatko kantasolut parantaa HIV-taudin?
Yli 50 vuotta sitten kehitettiin hoitoja joihinkin immuunijärjestelmän sairauksiin, ja ne ovat alkuperäisiä kantasoluhoitoja. Hoidoissa tuhotaan kaikki sairaat immuunisolut, kuten leukemiat, sädehoidolla ja syöpälääkkeillä. (6,7,8). Kun sairas immuunijärjestelmä on tuhottu, se korvataan siirtämällä uusia immuunisoluja terveen luovuttajan luuytimestä.
Luuydinsiirto: terveiden luuytimen kantasolujen siirto luovuttajalta vastaanottajalle, jonka oma immuunijärjestelmä on tuhoutunut
Tästä on nykyään tullut rutiinihoito monien syöpien ja verisairauksien hoitoon(1). HIV-pandemian alkuvaiheessa tunnustettiin, että luuydinsiirto voisi parantaa HIV-taudin. Tämän terapeuttisen lähestymistavan tiellä on kuitenkin ollut esteitä:
ensinnäkin kaikki vastaanottajan HIV-tartunnan saaneet CD4-solut on tuhottava ennen siirtoa. Jos näin ei tapahdu, luovuttajan luuydinsolut infektoituvat HIV:llä, ja elinsiirto on ollut turha. Koska säteily ja lääkkeet eivät tuhonneet kaikkia CD4-soluja kaikkialla elimistössä, siirretyn luuytimen infektioita havaittiin (2). Koska luuytimen tarjonta on rajallista, lääketieteellinen yhteisö oli haluton ”tuhlaamaan” arvokasta luuydintä HIV:n aiheuttamaan infektioon.
Toiseksi, siirretyn luuytimen on vastattava täydellisesti vastaanottajan soluja, tai uusi immuunijärjestelmä hyökkää niitä vastaan ”vieraana”, mikä johtaa henkeä uhkaavaan tilaan, joka tunnetaan nimellä ”siirteen ja isännän välinen tauti” (ks.: Potilaskohtaiset kantasolut). Koska vain harvat sopivat täydellisesti, luuytimen vastaanottajia hoidetaan yleensä immuniteettia hillitsevillä lääkkeillä. Koska HIV-tartunnan saaneiden henkilöiden immuunisuppressio johtaa aidsiin, tämä mahdollisuus rajoitti entisestään innostusta luuydinsiirtohoitoon HIV-taudin hoidossa ja rajoitti sen koskemaan vain niitä henkilöitä, joille kehittyi myös syöpä, jonka hoitoon luuydinsiirtoa tarvittiin.
Tärkeää on, että vuonna 2009 New England Journal of Medicine -lehdessä(3) raportoitiin todisteet luuydinsiirron tehokkuudesta HIV-taudin hoidossa. Saksalainen lääkäriryhmä, joka hoiti HIV-tartunnan saanutta miestä, jolla oli syöpä, lymfooma, luuydinsiirrolla, pystyi käyttämään luuydintä, joka oli peräisin yksilöltä, joka oli luonnostaan vastustuskykyinen HIV-infektiolle. Aiemmista raporteista poiketen uudet luuydinsolut eivät saaneet HIV-tartuntaa.
Mitä on luonnollinen resistenssi HIV-infektiota vastaan?
Tutkimukset henkilöistä, jotka olivat rutiininomaisesti altistuneet HIV:lle, mutta jotka eivät saaneet tartuntaa, osoittivat, että sen lisäksi, että soluilla on CD4-proteiini, tehokas infektio tarvitsee myös jommankumman kahdesta muusta reseptoriproteiinista, joita kutsutaan nimillä CXCR4 ja CCR5. CXCR4 on proteiini, joka ilmentyy monien solujen, ei vain CD4-solujen, pinnalla, mutta CCR5 ilmentyy harvemmin. Henkilöt, joilta geneettisesti puuttuu CCR5, vaikuttavat normaaleilta ja osoittavat huomattavaa vastustuskykyä HIV-infektiota vastaan. Saksalaisen potilaan luuydinluovuttajalta puuttui geneettisesti CCR5-proteiini.
Miten kantasoluilla voidaan hoitaa HIV-tautia?
Saksasta saatu proof-of-concept -raportti tukee luuydinsiirron arvoa HIV-taudin hoidossa. Uusi kehitys kantasolututkimuksessa avaa uusia väyliä tämän terapeuttisen lähestymistavan suurimpien esteiden ratkaisemiseksi.
Yksi, mahdollisuus johtaa potilasspesifisiä kantasoluja (ks.: Potilasspesifiset kantasolut) poistaa arvokkaan luuytimen tuhlaamisen.
Toiseksi, laboratoriomenetelmät luuytimen kantasolujen kehittämiseksi potilasspesifisistä kantasoluista ovat edistyneet huomattavasti viimeisten parin vuoden aikana (4), minkä ansiosta luuydinpankista saatavan kudos- ja kudosnäytteiden hyvän yhteensopivuuden tarvetta ei enää tarvita.
Kolmanneksi, myös laboratoriomenetelmät kantasolujen geenien hiljentämiseksi ovat kehittyneet huomattavasti kahden viime vuoden aikana(5).
Kokonaisuutena on nyt mahdollista saada potilaskohtaisia kantasoluja HIV-tartunnan saaneista henkilöistä, erilaistaa ne luuytimen kantasoluiksi ja tyrmätä CCR5-proteiini, jolloin ne ovat vastustuskykyisiä HIV-infektiolle. Tämä solulähde olisi sitten käytettävissä siirrettäväksi HIV-tartunnan saaneelle henkilölle, jonka on mahdollisesti tai mahdollisesti ei tarvitse valmistautua siihen käymällä läpi säteily- ja lääkehoitoa kaikkien HIV-tartunnan saaneiden solujen täydelliseksi poistamiseksi. Koska uudet solut eivät ole alttiita HIV-infektiolle, voi olla mahdollista, että ajan mittaan ne yksinkertaisesti korvaavat yksilön HIV-tartunnan saaneet solut.
Mikä on aikataulu potilaskohtaisten, CCR5-negatiivisten luuytimen kantasolujen kehittämiselle HIV:n hoitoon?
Potilaskohtaisten kantasolujen tieteenala etenee nopeasti. Vuoden 2011 puoliväliin mennessä parhaat lähteet voivat olla käsillä. Samassa ajassa selviävät myös tehokkaimmat laboratoriomenetelmät kantasolujen kehittämiseksi luuytimen kantasoluiksi. Vuosi 2012 on siis realistinen aikataulu luotettavien menetelmien kehittämiselle potilaskohtaisten luuytimen kantasolujen tuottamiseksi.
Laboratoriomenetelmät CCR5-proteiinin tyrmäämiseksi voivat myös kestää 2-3 vuotta. Useita menetelmiä tutkitaan parhaillaan(5).
Kun CCR5-negatiiviset, potilasspesifiset luuytimen kantasolut ovat käytettävissä, mahdollisesti vuoteen 2013 mennessä, niiden turvallisuutta ja tehoa on tutkittava. Tämä saattaa olla työn pisin vaihe, sillä pitkäaikainen eloonjääminen ja negatiivisten sivuvaikutusten puuttuminen on osoitettava eläinmallissa. Varovainen arvio tälle vaiheelle on 3-5 vuotta.
Jos rahoitus on saatavilla, 5-8 vuoden kuluessa tiedetään siis, ovatko potilaskohtaiset, CCR5-negatiiviset luuytimen kantasolut hyödyllinen väline HIV-taudin torjunnassa.
Koituvatko kustannukset liian korkeiksi?
Kunnes tiedetään, millä tehokkuudella potilaskohtaisia, CCR5-negatiivisia luuytimen kantasoluja voidaan johtaa, ei ole mahdollista ennustaa hoitokohtaisia kokonaiskustannuksia.
Mutta kun otetaan huomioon, että HIV-taudin seurannan ja hoidon nykyiset kustannukset ovat 25 000-50 000 dollaria vuodessa potilasta kohti Yhdysvalloissa, on erittäin todennäköistä, että kantasoluhoito voi olla huomattavasti edullisempaa.
Bedford Researchin tutkijat aloittavat potilaskohtaisen kiveksen kantasoluprojektin vuonna 2010 heti, kun rahoitus on käytettävissä.
- Kiessling AA ja Anderson SC 2007 Human Embryonic Stem Cells, Jones and Bartlett plublishers
- Krishnan A,Zaia J, ja Forman SJ 2003. Pitäisikö HIV-positiivisille lymfoomapotilaille tarjota kantasolusiirtoja? Bone Marrow Transplantation 32: 741-748
- Hutter G, Nowak D, Mosner M, Ganepola S, Mubig A, Allers K, Schneider T, Hofmann J, Kucherer C, Blau O, Blau I, Hofmann W, Thiel E 2009. New England Journal of Medicine 360: 693-698.
- Goodrich A, Ersek A, Varain N, Groza D, Cenariu M, Thain D, Almeida-Porada G, Porada C, Zanjani E 2010. In vivo b-solujen kaltaisten solujen tuottaminen ihmisen alkion kantasoluista erilaistetuista CD34+-soluista. Experimental Hematology 38: 516-525.
- Shimizu S, Hong P, Arumugam B, Pokomo Ll, Boyer J, Koizumi N, Kittipongdaja P, Chen A, Bristol G, Ballic Z, Zack J, Yang O, Chen I, Lee B, An D 2010. Erittäin tehokas lyhyt hiusneula-RNA alentaa voimakkaasti CCR5-ekspressiota systeemisissä imukudoselimissä hu-BLT-hiirimallissa. Blood 115: 1534-1544.
.