Histonimodifikaatio | EpiGentek
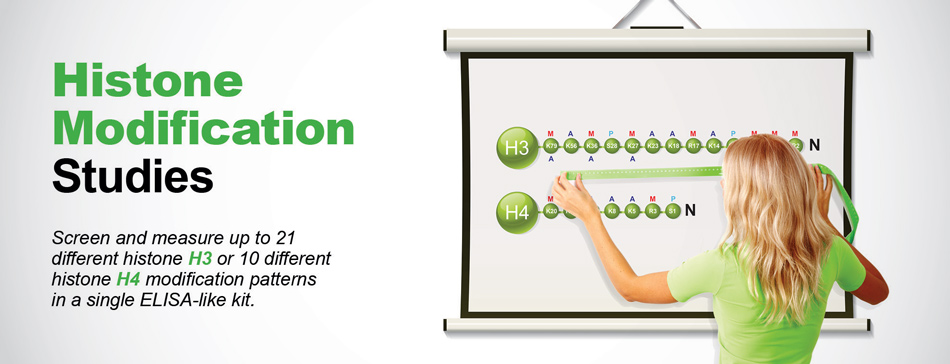
Täydelliset ratkaisut histonimodifikaatiotutkimuksiin
Histonit ovat eukaryoottisen kromatiinin ensisijaisia proteiinikomponentteja, ja niillä on merkitystä geenien säätelyssä. H3- ja H4-histoneilla on nukleosomista ulkonevat hännät, joita voidaan modifioida posttranslationaalisesti muuttamaan histonin vuorovaikutusta DNA:n ja ydinproteiinien kanssa, mikä johtaa epigeneettisiin muutoksiin monien normaalien ja sairauksiin liittyvien prosessien säätelyssä. Epigentek tarjoaa täydellisen sarjan kittejä, jotka ovat saatavilla H3-histonien metylaation, asetylaation ja fosforylaation kvantifiointiin kaikissa paikoissa (katso informatiivinen histonimodifikaatiotaulukko).
Tarjoamme kattavimman valikoiman histonimodifikaatiotutkimustuotteita, jotka kattavat kokeen työnkulun jokaisen vaiheen, ylävirrasta alavirtaan.
Aloittaminen on helppoa H3 & H4 Multiplex Assays
Screenaa ja mittaa jopa 21 erilaista histoni H3:n tai 10 erilaista histoni H4:n modifikaatiomallia yhdellä ainoalla ELISA:n kaltaisella kitillä.
- EpiQuik Histone H3 Modification Multiplex Assay Kit (kolorimetrinen)
Screenaa ja mittaa samanaikaisesti 21 erilaista, tarkoin karakterisoitua histoni H3-modifikaatiomallia yhdessä vain 2,5 tunnissa. - EpiQuik Histone H4 Modification Multiplex Assay Kit (kolorimetrinen) Yksinkertaisella 2 tunnin ja 30 minuutin menettelyllä voit havaita ja kvantifioida lähes kaikki histoni H4-modifikaatiot (10 eri tyyppiä) samanaikaisesti.
- EpiQuik Circulating Modified Histone H3 Multiplex Assay Kit (kolorimetrinen)
Tunnista ja kvantifioi samanaikaisesti jopa 22 erilaista, hyvin karakterisoitua modifioitua histoni H3-mallia suoraan plasmasta/seerumista vain 2,5 tunnissa.
Histonin metylaatiovasta-aineet
Histonin lysiinimetylaatio, histonin arginiinimetylaatio ja muut histonin metylaatiovasta-aineet.
Histonin asetylaatiovasta-aineet
Histonin lysiiniasetylaatio, HDAC ja muut histonin asetylaatiovasta-aineet.
Histoni-metylaatio
Histoni-metylaationa tunnettu mekanismi on translaation jälkeinen epigeneettinen modifikaatio, jossa metyyliryhmiä siirretään histoniproteiineihin histonimetyylitransferaasien (HMT) välityksellä. Metyyliryhmiä lisätään histoniproteiineista ulkoneviin ”häntiin”, jotka ovat yleisin paikka posttranslationaalisille modifikaatioille, erityisesti N-terminaalisille hännille. Vaihtoehtoisesti histonien demetylaatio on metyyliryhmien poistamista histonien hännistä, jota katalysoivat histonidemetylaasit (HDM). Histonin metylaatio ja histonin demetylaatio ovat epigeneettisiä modifikaatioita, joilla on valta vähentää tai vahvistaa geeniekspressiota erityisesti kromatiinin rakenteen muuttamisen seurauksena.
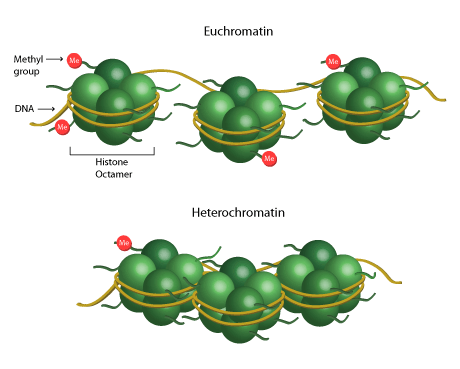
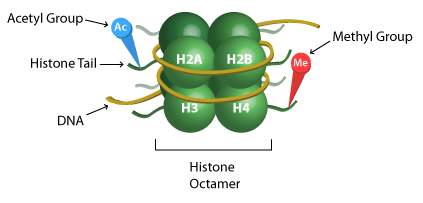
Histoni on proteiini, joka auttaa muodostamaan kromatiinin rakenteen, joka koostuu DNA:n ympärille käärityistä proteiini-oktameereista. Nämä oktameerit koostuvat neljän ydinhistonin (H2A, H2B, H3 ja H4) kaksoiskappaleista. Tätä kromatiinin yksikköä kutsutaan yleisesti nukleosomiksi. Transkription repressio tai aktivaatio voi tapahtua histonien metylaation tai demetylaation seurauksena kromatiinirakenteen löystymisen tai rajoittumisen vuoksi. Heterokromatiini ja eukromatiini viittaavat kromatiinirakenteeseen, joka koostuu joko tiukasti tai löyhästi pakkautuneesta DNA:sta histonien ympärille. Heterokromatiini on transkriptiivisesti inaktiivista, kun taas euchromatiini on transkriptiivisesti aktiivista.
Missä ja kuinka monta metyyliryhmää histoneihin on lisätty, määrittää suurelta osin sen, onko kromatiini transkription käytettävissä vai ei. Hännän jäännökset – lysiini (K) ja arginiini (R) – voivat metyloitua eriasteisesti eri tuloksin. Kun esimerkiksi histoni H4:n lysiini 20 on monometyloitu (H4K20me1), tämä yleinen histonimodifikaatio johtaa kromatiinin supistumiseen. Kromatiinin rakenteen rajoittuminen estää transkriptiota ja vähentää geeniekspressiota. Vaihtoehtoisesti histoni H3:n monometylaatio arginiini 17:ään (H3R17me1) johtaa transkription aktivoitumiseen.

Lysiinimetylaatio on osallistunut sekä transkription aktivointiin (H3K4, K36, K79) että vaimentamiseen (H3K9, K27, H4K20), ja näiden histonimodifikaatioiden vaikutusten tutkiminen antaa tutkijoille mahdollisuuden ymmärtää paremmin, miten erilaisten metyyliryhmien siirtäminen tai poistaminen eri määrien lysiini- tai arginiiniryhmiin tai eri lysiini- tai arginiinijäänteistä vaikuttaa geenien ilmenemiseen. ”Histonikoodi” pyrkii kuvaamaan tapaa, jolla histonimodifikaatiot toimivat yhdessä erilaisina yhdistelminä tiettyjen soluprosessien kontrolloimiseksi.
Mittaamalla histonimodifikaatioita tutkijat voivat paljastaa uusia epigeneettisiä oivalluksia soluprosesseista ja sairaustiloista. Epänormaalit modifikaatiot on esimerkiksi yhdistetty lukuisiin eri sairauksiin syövästä autoimmuunisairauksiin sekä tulehdus- ja neurologisiin sairauksiin. Sen lisäksi, että histonimodifikaatioiden havaitseminen auttaa ymmärtämään paremmin patologisen tautiprosessin epigeneettistä perustaa, se voi myös auttaa kehittämään histonimodifikaatioihin kohdistuvia lääkkeitä.
EpiQuik Histone H3 Modification Multiplex Assay Kit -määrityssarjan avulla saat kokonaiskuvan näytteesi histonimodifikaatiotilanteesta. Tämä ELISA:n kaltainen menetelmä vaatii vain tavallisen mikrolevylukijan. Säästä aikaa ja rahaa mittaamalla samanaikaisesti 21 eri histoni H3-modifikaatiota, jotka sisältävät kaikki tärkeimmät ja parhaiten karakterisoidut mallit:
| H3K4me1 | H3K4me2 | H3K4me3 | H3K9me1 | H3K9me2 | H3K9me3 | |
| H3K27me1 | H3K27me2 | H3K27me3 | H3K36me1 | H3K36me2 | H3K36me3 | |
| H3K79me1 | H3K79me2 | H3K79me3 | H3K9ac | H3K14ac | H3K18ac | |
| H3K56ac | H3ser10P | H3ser28P | Kokonais H3 | Kokonais H3 | . |
EpiQuik Histone H4 Modification Multiplex Assay Kitin avulla voit mitata 10 eri histoni H4-modifikaatiota yksinkertaisesti, ELISA-tyyppisessä muodossa, joka sisältää lähes kaikki histoni H4:n modifikaatiokohdat:
| H4K5ac | H4K8ac | H4K12ac | H4K16ac | H4R3me2a | H4R3me2s | |
| H4K20me1 | H4K20me2 | H4K20me3 | H4K20me3 | H4ser1 | Total H4 |
Histoniasetylaatio
Histoniasetylaatio on epigeneettinen modifikaatio, jolle on ominaista asetyyliryhmän lisääminen histoniproteiineihin, erityisesti N-terminaalisen hännän sisällä oleviin lysiinijäämiin. Tätä histonimodifikaatiota katalysoivat entsyymit, joita kutsutaan histoniasetyltransferaaseiksi (HAT). HAT:ien kaksi eri tyyppiä – sytoplasminen ja nukleaarinen – määräytyvät solunsisäisen sijainnin ja histonispesifisyyden perusteella. Vaihtoehtoisesti histonideasetylaasit (HDAC) toimivat poistamalla asetyyliryhmiä prosessissa, jota kutsutaan histonideasetylaatioksi.
Kuten muutkin histonimodifikaatiot, histonien asetylaatio/deasetylaatio vaikuttaa kromatiinirakenteeseen ja vuorostaan geeniekspressioon tekemällä DNA:sta transkription kannalta helpommin tai huonommin lähestyttävää. Lysiinijäämien asetylaatio johtaa transkriptiivisesti aktiiviseen kromatiinirakenteeseen (euchromatiini) ja deasetylaatio johtaa inaktiiviseen, tiivistettyyn kromatiinirakenteeseen (heterokromatiini).
HDAC:ien pääluokkia on neljä: Luokka I, luokka II, luokka III ja luokka IV. HDAC1, HDAC2, HDAC3 ja HDAC8 kuuluvat luokkaan I. HDAC4, HDAC5, HDAC6, HDAC7, HDAC9 ja HDAC10 kuuluvat luokkaan II. Seitsemän sirtuiinia, mukaan lukien SIRT1-SIRT7, kuuluvat luokkaan III. Luokkaan IV kuuluu ainoastaan HDAC11. Nämä luokittelut perustuvat niiden homologisuuteen hiivaproteiinien kanssa.
Tutkimalla histonien asetylaatiota ja histonien deasetylaatiota tutkijat voivat saada lisää tietoa ”histonikoodista”. Tämä tutkimus voi myös edistää HDAC:lle suunnattujen lääkkeiden kehittämistä. Esimerkiksi histonideasetylaasin estäjiä (HDACi) käytetään usein mielialan stabilisaattoreina ja epilepsialääkkeinä, ja viime aikoina niitä on sovellettu mahdollisina syövän, neurodegeneratiivisten ja tulehdussairauksien hoitokeinoina. Mielenkiintoista on, että HDAC-inhibiittoreilla tiedetään olevan spesifisyys kasvainsoluja kohtaan, mikä saattaa selittää niiden laajamittaisen käytön syöpälääkkeinä.
Katso Histoniasetylaatio & Deasetylaatiokitit
Histonifosforylaatio
Histonifosforylaatio on posttranslationaalinen modifikaatio, joka kohdistuu seriini-, treoniini- ja tyrosiinijäämiin. Siihen liittyy fosforyyliryhmän lisääminen histonin häntäosiin, mikä voi olla osallisena kromatiinin uudelleenmuotoilussa. On mahdollista, että kaikki neljä nukleosomaalista histonin häntää ovat fosforyloituja. Yksi tunnetuimmista histonifosforylaation tehtävistä liittyy solujen reaktioon DNA-vaurioon. Vaikka lukuisia fosforylaatiopaikkoja on löydetty, uusia paikkoja paljastuu jatkuvasti epigeneettisessä tutkimuksessa.
See Histone Phosphorylation Kits