10.6: Traducción Procariótica
Tan pronto como el ARN ha salido del RNAP y hay espacio suficiente para acomodar un ribosoma, la traducción puede comenzar en procariotas. De hecho, en el caso de los genes altamente expresados, no sería raro ver múltiples ARN polimerasas transcribiendo el ADN y múltiples ribosomas en cada uno de los transcritos traduciendo el ARNm a proteína. El proceso comienza con la subunidad ribosómica pequeña (y sólo la pequeña, ya que si está unida a la grande, no puede unirse al ARNm), que se une al ARNm de forma suelta y comienza a buscar una secuencia de reconocimiento llamada secuencia Shine-Dalgarno, en honor a sus descubridores. Una vez que ésta es reconocida por la subunidad ribosomal pequeña ARNr, ésta se posiciona alrededor del codón de inicio (AUG). Este proceso se ve facilitado por los factores de iniciación, tal y como se indica a continuación.
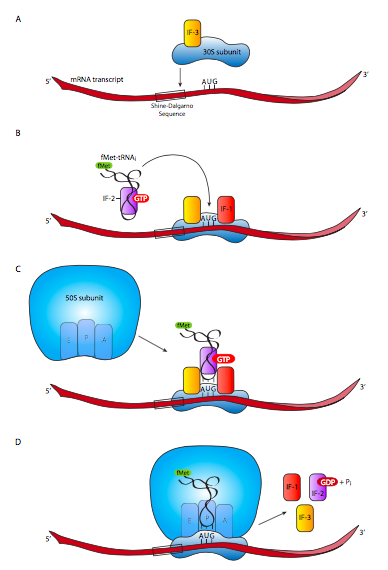
La subunidad ribosomal 30S se disocia de la subunidad ribosomal 50S si estaba asociada a una, y se une a los factores de iniciación IF-1 e IF-3. El IF-1 se une al sitio A, donde impide que entren nuevas moléculas de aminoacil-ARNt antes de que se ensamble el ribosoma completo. También facilita el ensamblaje y la estabilización del complejo de iniciación. El IF-3 es necesario para permitir que la subunidad 30S se una al ARNm. Una vez que esto ha ocurrido, el IF-2-GTP llega a la escena, llevando consigo el aminoacil-ARNt iniciador. Este se asienta en el sitio P, que se sitúa de forma que el anticodón del ARNt se asienta sobre el codón de inicio AUG del ARNm. La hidrólisis del GTP unido al IF-2 y la liberación de todos los factores de iniciación son necesarias para permitir que la subunidad 50S se una a la subunidad 30S para formar el ribosoma completo y totalmente funcional. Al ser necesaria la hidrólisis de GTP, la unión de las subunidades es irreversible de forma espontánea y requiere un gasto de energía al finalizar la traducción. Una vez que la subunidad 50S se une a la subunidad 30S, el sitio A está listo para aceptar el siguiente aminoacil-ARNt.
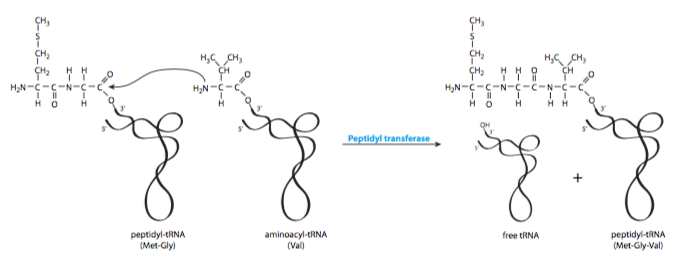
Una idea errónea común y comprensible es que el nuevo aminoácido traído al ribosoma se añade a la cadena polipeptídica en crecimiento. De hecho, el mecanismo es exactamente el contrario: el polipéptido se añade sobre el nuevo aminoácido (Figura \(\PageIndex{4}\)). Esto comienza a partir del segundo aminoácido que se añade a una nueva proteína (Figura \(\PageIndex{5}\)). El primer aminoácido, una metionina, debe recordar, entró junto con el IF-2 y el ARNt iniciador. El nuevo aminoacil-ARNt es escoltado por el EF-Tu, un factor de elongación que lleva un GTP. Una vez que el aa-ARNt está en su sitio, el EF-Tu hidroliza el GTP y se disocia del aminoacil-ARNt y del ribosoma.
Durante mucho tiempo, hubo un poco de misterio en torno al acoplamiento simultáneo de dos moléculas de ARNt en codones inmediatamente adyacentes del ARNm. En condiciones normales, no debería haber suficiente espacio, ya que los ARNt son bastante voluminosos y uno debería impedir que el otro llegara al ARNm para hacer coincidir codón-anticodón. El asunto se aclaró finalmente en 2001 con exámenes cristalográficos de rayos X que mostraron una curva en el ARNm entre el codón de la ranura P y el codón de la ranura A. La curvatura coloca a los dos ARNt asociados en ángulos ligeramente diferentes y, por tanto, crea el espacio suficiente para que ambos mantengan enlaces de hidrógeno de pares de bases con el ARNm. Véase Yusupov et al, Science 292 (5518): 883-896, 2001.
Cuando un nuevo aminoacil-ARNt cae en la ranura A del ribosoma, el anticodón se alinea con el codón del ARNm. Si no hay complementariedad, el aminoacil-ARNt vuelve a salir de la ranura para ser sustituido por otro candidato. Sin embargo, si hay complementariedad (o algo lo suficientemente cercano, recordando la idea del bamboleo) entonces se forman enlaces H entre el codón y el anticodón, el ARNt cambia de conformación, lo que desplaza la conformación del EF-Tu, provocando la hidrólisis de GTP a GDP + Pi, y la liberación del aa-ARNt. La interacción codón-anticodón es lo suficientemente estable como para que la actividad catalítica del ribosoma hidrolice el enlace entre fMet y el ARNtf en la ranura P, y una el fMet al nuevo aminoácido con un enlace peptídico en la ranura A. El nuevo aminoácido sigue unido a su ARNt, y mientras ocurre este proceso, el ribosoma cambia de posición con respecto al ARNm y a los ARNt. Esto coloca el ARNtf ahora vacío (sin aminoácido unido) en la ranura E, el ARNtaa en la ranura P, unido a ese aa que está unido al Met, y la ranura A está de nuevo abierta para que entre un nuevo ARNt. El factor de elongación EF-G se une cerca de la ranura A en cuanto sale el EF-Tu, y es necesario para la translocación ribosomal, proporcionando energía para el proceso mediante la hidrólisis de un GTP que lleva consigo al ribosoma. Por la experiencia de mis alumnos, la mejor manera de aprender esto parece ser estudiar los diagramas y ver los movimientos de las moléculas, rellenando los detalles mecanísticos en su mente. Este proceso continúa hasta que el ribosoma pone la ranura A en línea con un codón de parada.
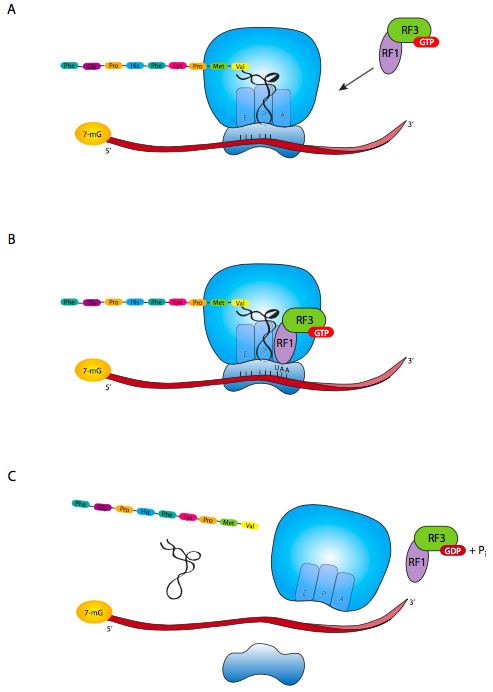
No hay ARNt con un anticodón para el codón de parada. En su lugar, hay un conjunto de factores de liberación que t en el sitio A del ribosoma, se unen al codón de parada y activan el ribosoma para cortar el enlace entre la cadena polipeptídica y el último ARNt (Figura \(\PageIndex{6}\)). Dependiendo de qué codón de parada esté presente, la RF1 (reconoce UAA o UAG) o la RF2 (para UAA o UGA) entra primero en la ranura A. El RF1 o el RF2 forman un complejo con el RF3, que participa en la posterior liberación del complejo RF de la ranura A. Esto es necesario porque una vez que el polipéptido ha sido liberado del ribosoma, el ARNm debe ser liberado. El factor de liberación del ribosoma (RRF) también se une a la ranura A, lo que provoca un cambio conformacional en el ribosoma liberando el ARNt anterior y ahora vacío. Por último, el EF-G se une al RRF y, junto con la hidrólisis del GTP, provoca la disociación del ribosoma en subunidades grandes y pequeñas. Obsérvese que es la combinación de EF-G/RRF la que causa la disociación; EF-G por sí solo desempeña un papel diferente en el movimiento del ribosoma cuando no está en el codón de parada.